Perkutánna endoskopická gastrostómia v liečbe pacientov s pokročilými nádormi hlavy a krku
Hajtmanová E., Hajtman A., Kinclová I., Muríň P., Lietava P., Hajtman A., Péč M.: Percutaneous Endoscopic Gastrostomy in the Therapy of Patients with Advanced Head and Neck Tumors
Aim:
The aim was to assess the role of percutaneous endoscopic gastrostomy (PEG) in the treatment of patients with advanced head & neck tumors.
Methods:
Patients with malignant tumors of the head and neck region are often in locally advanced stage and suffer from various degrees of malnutrition at the time of diagnosis. Toxicity of chemoradiotherapy worsens the unfavorable nutritional status and often leads to treatment gaps or even premature treatment termination. PEG was applied prophylactically to retain the nutritional status of treated patients and to mitigate the adverse reactions to radiotherapy. In the retrospective analysis we assessed the importance of percutaneous endoscopic gastrostomy that was implanted prophylactically in the treatment of 83 patients with advanced head & neck tumors. The time interval from the date of diagnosis to the start of radiotherapy treatment, the treatment gaps caused by radiotoxicity; and the loss of body weight during the treatment in the two groups of patients – with prophylactic PEG and without PEG was analyzed. At the same time we assessed the influence of these factors on the overall survival.
Results:
The time interval between the diagnosis of malignant head &neck tumor and the start of chemoradiotherapy treatment was on average 39.2 days for patients diagnosed and treated in Martin University Hospital compared to 51.7 days for patients diagnosed in different hospitals. The toxicity of concomitant chemoradiotherapy in the treatment of patients with malignancies in the head & neck region is manifested by severe odynophagia, dysphagia, xerostomia, dysgeusia and malnutrition; and it is associated with a high risk of treatment interruptions and early termination of radiotherapy. In the group of patients who had PEG during the treatment, the treatment gaps caused by acute radiotoxicity were on average 3.6 days shorter compared to patients without PEG. The weight loss was on average 4.3 kg for patients with PEG, compared to 6.9 kg in the control group of patients without PEG. The evaluation of prognostic factors – gender, age, stage, treatments gaps caused by treatment toxicity and chemoradiotherapy with prophylactic PEG implantation – showed that treatment interruptions lasting more than 5 days and chemoradiotherapy treatment without preventive PEG were significant risk factors of 3-year survival.
Conclusion:
The results confirm that PEG implanted before the start of radiotherapy treatment reduces undesired interruptions of concomitant chemoradiotherapy in patients with advanced head & neck tumors and improves the overall survival. Percutaneous gastrostomy ensures enteral nutrition and hydratation of patients during manifestation of radiochemotherapy toxicity, it reduces the body weight loss during the treatment, positively influences morbidity of patients, it decreases the need of parenteral support treatment and it allows the majority of patients to take the ambulant treatment and to retain the adequate quality of life.
Key words:
advanced H&N tumors, percutaneous endoscopic gastrostomy (PEG), chemoradiotherapy.
:
E. Hajtmanová 1; A. Hajtman 2; I. Kinclová 1; P. Muríň 1; P. Lietava 3; A. Hajtman 4; M. Péč 5
:
Onkologické centrum UNM, Martin, prim. MUDr. E. Hajtmanová, Ph. D.
1; Klinika otorinolaryngológie a chirurgie hlavy a krku JLF UK a UNM, Martin, prednosta prof. MUDr. A. Hajtman, Ph. D.
2; 1. interná klinika JLF UK a UNM, Martin, prednosta prof. MUDr. M. Mokáň, DrSc.
3; Úrad pre dohľad nad zdravotnou starostlivosťou, pracovisko Martin, riaditeľ doc. MUDr. V. Máliš, CSc.
4; Ústav lekárskej biológie JLF UK a UNM, Martin, vedúci doc. MUDr. M. Péč, Ph. D.
5
:
Otorinolaryngol Foniatr, 60, 2011, No. 1, pp. 19-25.
:
Original Article
Cieľ:
Význam perkutánnej endoskopickej gastrostómie (PEG) v liečbe pacientov s pokročilými nádormi hlavy a krku.
Metódy:
Zhubné nádory oblasti hlavy a krku sú diagnostikované väčšinou v lokálne pokročilom štádiu s rôznym stupňom malnutrície. Toxicita chemorádioterapie spôsobuje zhoršenie nepriaznivého stavu výživy a vedie často k prerušeniu liečby. Na udržanie nutričného stavu liečených a zmiernenie toxických prejavov rádioterapie sme využili profylaktickú aplikáciu PEG. V retrospektívnej analýze sme hodnotili u 83 pacientov vplyv PEG na jednotlivé časové úseky simultánnej chemorádioterapie. U všetkých chorých sme sledovali časový interval medzi stanovením diagnózy a začiatkom liečby. Porovnaním skupiny liečených s PEG a bez PEG sme hodnotili dĺžku prerušení liečby, spôsobených akútnou rádiotoxicitou. Súčasne sme porovnávali pokles telesnej hmotnosti počas liečby v obidvoch skupinách a vplyv prognostických faktorov na celkové prežívanie – overall survival (OS).
Výsledky:
Časový interval medzi stanovením diagnózy zhubného nádoru oblasti hlavy a krku v Univerzitnej nemocnici v Martine a začiatkom chemorádioterapie bol v priemere 39,2 dní oproti 51,7 dňom u pacientov, diagnostikovaných v iných nemocniciach. Toxicita konkomitantnej chemorádioterapie malignít ORL oblasti s obrazom ťažkej odynofágie, dysfágie, xerostómie, dysgeuzie a malnutrície je spojená s vysokým rizikom prerušení liečby. V skupine sledovaných pacientov s PEG sme zaznamenali prerušenia liečby, spôsobené akútnou rádiotoxicitou, kratšie v priemere o 3,6 dňa a priemerný pokles hmotnosti pacientov s PEG o 4,3 kg, oproti 6,9 kg v kontrolnej skupine bez PEG. Zo sledovaných prognostických faktorov - pohlavie, vek, štádium ochorenia, dĺžka prerušenia liečby z dôvodu toxicity liečby a chemorádioterapia s profylaktickou aplikáciu PEG, bol potvrdený ako negatívny prognostický faktor 3-ročného prežívania len interval prerušení liečby nad 5 dní a chemorádioterapia bez profylaktickej PEG.
Záver:
Získané výsledky potvrdzujú, že zavedenie PEG pred začiatkom liečby jednoznačne redukuje nežiaduce prerušenia konkomitantnej chemorádioterapie u pacientov s pokročilými nádormi hlavy a krku a predlžuje ich prežívanie. Perkutánna gastrostómia zabezpečuje enterálnu výživu a hydratáciu pacientov počas toxických prejavov rádiochemoterapie, znižuje straty telesnej hmotnosti počas liečby, pozitívne ovplyvňuje morbiditu pacientov, znižuje potrebu parenterálnej podpornej liečby a umožňuje väčšine chorých absolvovať liečbu ambulantne so zachovaním primeranej kvality života.
Kľúčové slová:
pokročilé nádory hlavy a krku, perkutánna endoskopická gastrostómia (PEG), chemorádioterapia.
ÚVOD
Zhubné nádory v oblasti hlavy a krku sú piatym najčastejším nádorovým ochorením a predstavujú jednu z popredných príčin úmrtí na zhubné ochorenia (4). Je známy celý rad faktorov, ktoré zvyšujú riziko ich vzniku. Ochorenie je u 75–80 % pacientov diagnostikované ako lokálne pokročilé, charakterizované predovšetkým lokálnym rastom a metastázovaním lymfatickou cestou. Prognóza pokročilej choroby je nepriaznivá, 5-ročné prežívanie je 20–30% (10). V terapii včasných štádií nádorovej choroby hlavy a krku je indikovaná jedna liečebná modalita: operácia alebo rádioterapia. Liečba pacientov s pokročilými štádiami choroby je kombinácia operácie, rádioterapie, chemoterapie a biologickej liečby. Spojenie týchto terapeutických modalít má však okrem vyššej lokálnej kontroly aj vyššiu toxicitu liečby. Pacienti s nádormi v hornej časti aerodigestívneho traktu majú už v čase stanovenia diagnózy vysoké riziko vzniku malnutrície. Následná multimodálna liečba významne zhoršuje primárne nepriaznivý stav ich výživy (20). Príčinou poruchy výživy je kombinácia prehĺtacích ťažkostí, spôsobených zhubným nádorom, a nežiaducich účinkov rádioterapie, resp. simultánnej chemorádioterapie.
Ožarovanie nádorov v oblasti hlavy a krku spôsobuje akútne reakcie na slizniciach ústnej dutiny, hltana a krčnej časti pažeráka. Počas liečby vzniká slizničný erytém, ulcerácie, pseudomembrány až nekrózy tkaniva. Súčasne sú negatívne postihnuté chuťové poháriky, je pozorovaná dysgeuzia až ageuzia a vplyv na slinné žľazy sa prejaví vznikom rôznych stupňov xerostómie (14). Mukozitída výrazne zhoršuje odynofágiu a zvyšuje riziko infekcií. Z časového hľadiska vzniká akútna radiačná toxicita v priebehu liečby a pretrváva až tri mesiace po liečbe. Ak sa liečebný režim intenzifikuje, akútne toxické zmeny môžu pretrvávať aj nad túto konsenzuálnu časovú hranicu (6). Závažná mukozitída je často vynútenou prekážkou ukončenia onkologickej liečby v plánovanom čase, čo negatívne ovplyvňuje tzv. časový faktor v rádioterapii – dodržanie celkového času liečby (21). Prerušenie liečby na dobu dlhšiu ako jeden týždeň spôsobuje štatisticky významné zníženie lokálnej kontroly nádoru a zhoršuje celkové prežívanie liečených (19).
Liečebnú odpoveď ovplyvňuje negatívne aj zlý nutričný stav pacientov, spôsobený okrem toxicity liečby aj lokalizáciou zhubného nádoru, znemožňujúcou až brániacou perorálnemu príjmu potravy. Na udržanie nutričného stavu pacientov liečených chemorádioterapiou je vhodná sondová enterálna výživa. Výhodou oproti parenterálnej výžive je zachovanie integrity a funkcie čreva za súčasnej podpory imunitného systému. Preventívne zaistenie sondovej výživy pred začatím liečby zabezpečuje intenzívnu podpornú liečbu a dostatočnú hydratáciu. Včasná aplikácia sondovej výživy zabráni významnej strate telesnej hmotnosti počas onkologickej liečby a minimalizuje riziko jej predĺženia. Zníženie potreby parenterálnej výživy a redukcia hospitalizácií pacientov s komplikáciami spojenými s malnutríciou umožní väčšine pacientov absolvovať liečbu ambulantne (11, 15).
Sondová enterálna výživa je fyziologická metóda podávania živín sondou zavedenou do žalúdka, duodena alebo jejuna. Možnosti zabezpečenia sondovej výživy v súčasnosti sú: nasogastrickou sondou, perkutánnou endoskopickou gastrostómiou– PEG, rádiologicky asistovanou gastrostómiou a chirurgickou gastrostómiou alebo jejunostómiou (18). Výživa nasogastrickou sondou je vhodná len na obdobie kratšie ako 6 týždňov. Dlhšie obdobie zvyšuje riziko vzniku dekubitov na sliznici nosa, nosohltana, pažeráka, krvácania a zvýšeného dráždenia sliznice v ožarovanej oblasti (20). Negatívom je značné obmedzenie komfortu pacienta. Perkutánna endoskopická gastrostómia–PEG je metódou voľby u chorých, u ktorých je predpoklad enterálnej výživy dlhší ako 6 týždňov. Rádiologicky asistovaná gastrostómia je aplikovaná pacientom, u ktorých nie je možné zaviesť gastroskop. Chirurgická, klasická Witzelova gastrostómia sa dnes používa len vzácne. Indikácia laparoskopicky asistovanej gastrostómie –PLAG (percutaneous laparoscopically assisted gastrostomy) je však stále metódou voľby u pacientov, kde nie je možné zaviesť gastroskop, alebo je riziko interpozície orgánov medzi žalúdkom a brušnou stenou (7).
V Onkologickom centre Univerzitnej nemocnice v Martine sme začali aplikovať profylaktickú PEG pacientom s lokálne pokročilými nádormi T3 - T4 v ORL oblasti od roku 2006. Boli to chorí s indikovanou postoperačnou rádiochemoterapiou, pacienti s primárne inoperabilným nádorom a indikovanou kuratívnou rádioterapiou, alebo pacienti s paliatívnou rádioterapiou, kde mala PEG zaisťovať ich výživu trvale. Časovo najoptimálnejšou bola realizácia PEG počas hospitalizácie na Klinike ORL a ChHaK ihneď po ukončení diagnostického procesu a histologickej verifikácii.
Cieľom retrospektívnej analýzy bolo hodnotenie vplyvu preventívnej aplikácie PEG na dĺžku prerušení rádiochemoterapie, vynútených toxicitou liečby. Súčasne sme hodnotili nutričný stav skupiny liečených s PEG a bez PEG v súvislosti so zmenou ich telesnej hmotnosti. Na zhodnotenie výsledkov liečby sme použili len celkové prežívanie pacientov. Objektívne informácie o lokoregionálnom bezpríznakom prežívaní (recurrence-free survival, RFS), hodnotené v mnohých publikovaných štúdiách, nebolo možné získať u väčšiny sledovaných z dôvodu problematickej spolupráce, súvisiacej so špecifickým spôsobom ich života.
MATERIÁL A METÓDY
V Onkologickom centre Univerzitnej nemocnice Martin (UNM) bolo od januára 2004 do mája 2010 sledovaných 83 pacientov s diagnózou lokálne pokročilého spinocelulárneho karcinómu hlavy a krku. Do sledovaného súboru neboli zaradení pacienti so zhubným ochorením nosohltana, hrtana, slinných žliaz a prinosových dutín. Ďalším vylučovacím kritériom bola celková dávka žiarenia na oblasť primárneho nádoru nižšia ako 58,0 Gy a prerušenia liečby žiarením z iných dôvodov ako rádiotoxicita (štátne sviatky, poruchy ožarovacieho prístroja) v celkovom trvaní viac ako 5 dní. Sledovaný súbor bol redukovaný o početnú skupinu pacientov, liečených počas vianočných a novoročných sviatkov, kedy pacienti odmietali prísť na ožarovanie v medzisviatkovom období.
Všetci hodnotení pacienti mali histologicky potvrdený spinocelulárny karcinóm G1 až G3. Výkonnostný stav chorých bol podľa Karnofského skóre ≥80. Od januára 2006 sme do liečebného procesu v spolupráci s Klinikou ORL a ChHaK a Gastroenterologickým pracoviskom 1. internej kliniky Jesseniovej lekárskej fakulty Univerzity Komenského a UNM zaradili aplikáciu PEG. U všetkých pacientov sledovaného súboru bola PEG zavedená pred konkomitantou chemorádioterapiou.
Samostatná konkomitantná chemorádioterapia bola aplikovaná u 69 pacientov. U 14 chorých tejto liečbe predchádzala resekcia primárneho nádoru s rôznym stupňom radikality a disekcia lymfatických uzlín. Pacienti boli ožarovaní na lineárnom urýchľovači s energiou brzdného fotónového žiarenia 6 MV. Liečba bola aplikovaná technikou 3 asymetrických polí do dávky žiarenia (TD) 44–50 Gy, s následnou redukciou ožarovaného objemu. U chorých bez operačnej liečby alebo so subradikálnou resekciou, bola plánovaná celková dávka žiarenia (cTD) 68-70 Gy a aplikovaná cTD v rozsahu 58-70 Gy. Po radikálnej resekcii bola plánovaná cTD 60-64 Gy a aplikovaná cTD v rozsahu 56-64 Gy. Konkomitantná rádiochemoterapia bola podávaná v režime CDDP 40 mg/m2 týždenne s dostatočnou hydratáciou a premedikáciou setronovými antiemetikami.
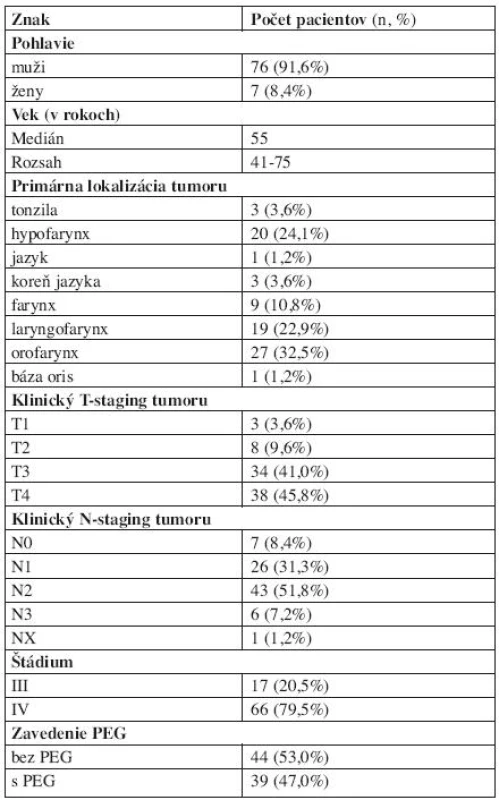
Charakteristiku súboru pacientov, rozdelených na skupinu s preventívne aplikovanou PEG a kontrolnú skupinu bez PEG, ukazuje tabuľka 1.
Celková doba sledovania bola 41 mesiacov. V tomto období bola hodnotená lokoregionálna kontrola nádoru mesiac po ukončení liečby ORL vyšetrením, sonografickým a CT vyšetrením dva mesiace po ukončení liečby a následne ORL vyšetrením v dvoj- až trojmesačných intervaloch. Ďalšie CT a sonografické vyšetrenia boli indikované podľa stavu pacienta. Lokoregionálne zlyhanie bolo potvrdené biopticky.
Metódy spracovania
Vstupné hodnoty analýzy boli dokumentované vo frekvenčných tabuľkách. Na výpočet prežívania pacientov bola použitá Kaplan-Meierova metóda a grafické znázornenie krivkami prežívania. Vplyv rôznych premenných bol vyhodnotený pomocou Mantel-Coxovho log-rank testu, ktorý sa využíva v prípade cenzorovaných údajov. Všetky p hodnoty boli výsledkom uvedených štatistických testov, za štatisticky významné boli považované hodnoty p<0,05. Na spracovanie a štatistickú analýzu všetkých údajov bola využitá aplikácia SPSS/PC Software package, verzia 17.0.
VÝSLEDKY
Pacienti hodnoteného súboru s PEG a bez PEG, liečení konkomitantnou chemorádioterapiou, boli sledovaní v období od 9 do 41 mesiacov. Medián prežívania všetkých chorých bol 18 mesiacov (539 dní). Pri poslednom sledovaní (41 mesiacov) prežívalo celkove 30,9 % pacientov (graf 1).

Štatistické porovnanie kriviek prežívania pre súbor pacientov bez PEG a s PEG ukazuje na hladine významnosti 0,95 signifikantne dlhšie prežívanie pacientov s PEG (log-rank test p=0,043, Wilcoxon test p=0,044). Medián prežívania pacientov s PEG bol 844 dní oproti 485 dňom u pacientov bez PEG (graf 2).

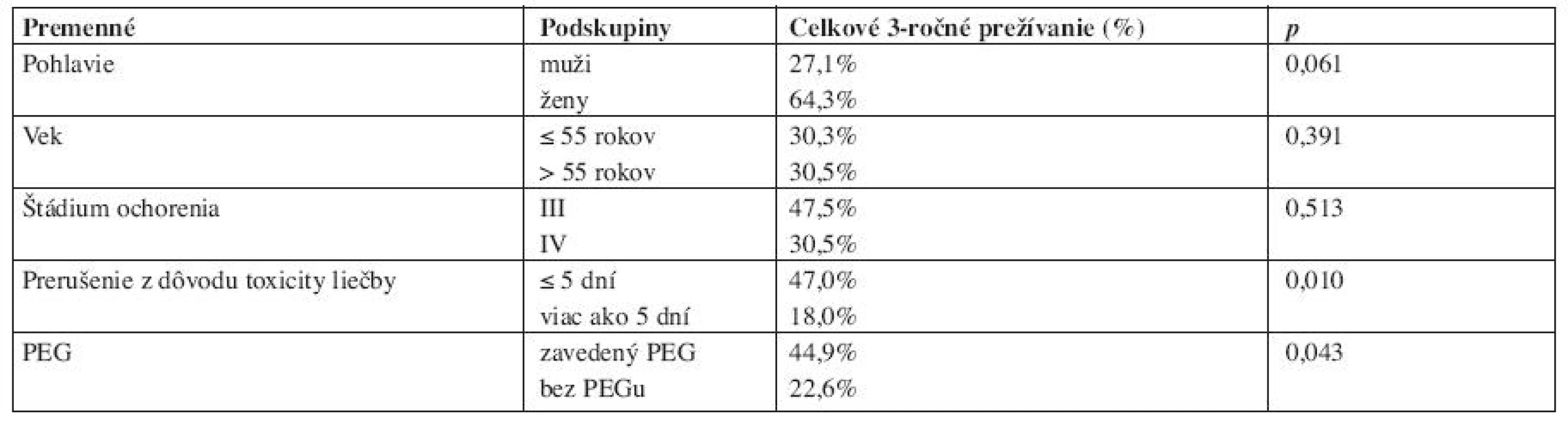
Prognostické faktory - pohlavie, vek, štádium ochorenia, dĺžku prerušenia liečby žiarením z dôvodu toxicity a chemorádioterapiu s profylaktickou aplikáciou PEG, sme hodnotili univariačnou Mantel-Coxovou analýzou vo vzťahu k 3-ročnému prežívaniu (tab. 2). Signifikantný vplyv na kratšie prežívanie (na hladine významnosti 0,95) mala dĺžka prerušenia liečby viac ako 5 dní (p=0,010) a liečba simultánnou chemorádioterapiou bez aplikácie PEG (p=0,043). Pohlavie, vek a štádium zhubného nádoru pacientov nemalo v sledovanom súbore chorých signifikantný vplyv na 3-ročné prežívanie liečených.
Pacienti, ktorým bola zhubná nádorová choroba diagnostikovaná v UNM a ktorí mali aplikovanú PEG, začali plánovanú chemorádioterapiu v priemere do 39,2 dní (v rozmedzí od 17 do 53 dní). Pacienti z iných nemocníc mali plánovanú liečbu zahájenú v priemere do 51,7 dní (v rozmedzí od 21 do 115 dní).
Priemerný počet dní bez liečby z dôvodu toxicity bol u pacientov s PEG 4,3 dňa (v rozmedzí od 0 do 12 dní) a u pacientov bez PEG 7,9 dňa (v rozmedzí od 4 do 21 dní).
Priemerný pokles telesnej hmotnosti po skončení liečby bol 5,6 kg (v rozmedzí od 0 kg do 21 kg). V skupine pacientov bez PEG bol priemerný pokles hmotnosti 6,9 kg (v rozmedzí od 4 do 21 kg a v skupine pacientov s PEG 4,3 kg (v rozmedzí od 0 do 12 kg).
DISKUSIA
Význam časového faktoru v rádioterapii spinocelulárneho karcinómu hlavy a krku je zdokumentovaný v mnohých publikovaných štúdiách. Predĺženie časového úseku medzi stanovením diagnózy a začiatkom liečby, medzi operáciou a začiatkom chemorádioterapie a predlžovanie samotnej rádioterapie, či už z dôvodu rádiotoxicity, poruchy ožarovacieho prístroja alebo dní pracovného pokoja, má negatívny vplyv na RFS a OS liečených (17). Aplikácia PEG pred začiatkom liečby ovplyvňuje všetky časové úseky liečby.
Vplyv dĺžky časového intervalu medzi stanovením diagnózy zhubného nádoru a začiatkom liečby analyzovali Jensen a spol. (8). Na súbore 648 pacientov, liečených pre spinocelulárny karcinóm v oblasti hlavy a krku, hodnotili vzťah medzi čakacou dobou na liečbu, objemom primárneho nádoru a stavom regionálnych lymfatických uzlín. Počas priemernej čakacej doby na liečbu v trvaní 4 týždňov bolo až u 62 % chorých zaznamenané merateľné zväčšenie primárneho nádoru a u 20 % bola zistená progresia metastatického postihnutia regionálnych lymfatických uzlín, čo znamenalo u 16 % pacientov zvýšenie stupňa TNM klasifikácie. Tiež Suwinski a spol. (17) vo svojej retrospektívnej štúdii o vplyve časového faktoru v pooperačnej rádioterapii upozorňujú na negatívny vplyv predlžovania časového intervalu medzi operačnou liečbou a začiatkom rádioterapie. Analýza Anga a spol. (1) predpokladá, že rozšírenie intervalu na 90 dní môže zhoršiť 5-ročné bezpríznakové prežívanie asi o 15 %.
Čakacie doby na liečbu boli v našich súboroch dlhšie u pacientov diagnostikovaných mimo UNM. Rozdiel bol až 12,5 dňa oproti priemernej čakacej dobe pacientov, diagnostikovaných v UNM. Jednou z príčin bola u týchto pacientov realizácia PEG pred začiatkom liečby až na našom pracovisku, čo oddialilo jej začiatok. Vďaka aktívnej spolupráci s niektorými ORL pracoviskami prichádzajú v súčasnosti mnohí pacienti na liečbu už s perkutánnou gastrostómiou.
Časove najúspornejším riešením bola aplikácia PEG na Klinike ORL a ChHaK v Martine, a to bezprostredne po diagnostike zhubného nádoru, alebo počas operačnej liečby. Za ďalšie výhody aplikácie PEG na ORL pracovisku považujú Hujala a spol. (5) možnosť kombinovať výkon s inými postupmi, ako je panendoskopia, tracheostómia a ďalšie biopsie, čo sa ukázalo výhodným aj v našich podmienkach.
Mnohé literárne práce potvrdzujú zhoršenie lokálnej kontroly nádorov v ORL oblasti predlžovaním celkovej doby (overall treatment time, OTT) rádioterapie alebo simultánnej chemorádioterapie. Pokles lokálnej kontroly pri predĺžení celkovej doby ožarovania o týždeň udávajú Saarilahti a spol. od 12 až do 18 % (16).
Za hlavnú príčinu zlyhania rádioterapie pri predlžovaní OTT je považovaná akcelerovaná repopulácia klonogénnych buniek zhubného nádoru. U spinocelulárnych karcinómov ORL oblasti k nej dochádza na 21. až 28. deň liečby a predpokladá sa, že každý deň predĺženia po tejto dobe znamená pokles účinnosti liečby, vyjadrený napríklad stratou dávky žiarenia približne 0,6 až 0,9 Gy na každú frakciu rádioterapie (21, 17). Snahou radiačných onkológov je preto skrátiť celkovú dobu ožarovania nekonvenčnými frakcionačnými režimami pri súčasnej minimalizácii ich prerušení. Zavedenie PEG pred začatím ožarovania považujeme za jednoduché a bezpečné opatrenie, znižujúce pravdepodobnosť prerušení liečby z dôvodu akútnej rádiotoxicity. Niekedy však pacienti aj napriek poučeniu odmietajú aplikáciu PEG a súhlasia s takýmto spôsobom enterálnej výživy až po vystupňovaní ťažkostí. Aplikácia PEG, resp. gastrostómie počas liečby žiarením, však znamená ďalšie prerušenie liečby, ale umožní jej pokračovanie. Profylaktická aplikácia PEG nesporne redukuje nežiaduce prerušenia liečby a ovplyvňuje prežívanie liečených. Potvrdzujú to aj výsledky našej retrospektívnej analýzy – štatisticky významný negatívny vplyv predĺženia OTT o viac ako 5 dní na 3-ročné prežívanie a súčasne štatisticky významné 3-ročné prežívanie 44,9 % liečených s PEG oproti 22,6 % bez PEG.
Kompletná enterálna výživa cez PEG bola plne využitá od začiatku liečby u dvoch pacientov zo sledovaného súboru. Zhubný nádor, ako mechanická prekážka, im úplne znemožňoval príjem potravy. U ostatných chorých bola čiastočne až plne využívaná až v období vrcholenia radiačnej toxicity. Pokles telesnej hmotnosti, ktorý sme zaznamenali celkove u 93 % pacientov, bol porovnateľný s 89 %, ktoré udávajú vo svojej štúdii Connor a spol. (3). Strata telesnej hmotnosti počas liečby bola u pacientov s PEG 4,3 kg, oproti 6,9 kg u pacientov bez PEG. Výsledky boli aj napriek malej skupine sledovaných podobné s publikovanými údajmi - v priemere 3,1 kg oproti 7,0 až 8,5 kg u pacientov bez PEG (9, 12).
Jednoduchá obsluha perkutánnej gastrostómie umožňovala pacientom z Martina a okolia absolvovať liečbu ambulantne. Starostlivosť o PEG zvládli v domácom prostredí aj chorí z najnižších sociálnych skupín. Morton a spol. (11) výstižne definovali preventívnu aplikáciu PEG ako nevyhnutnú súčasť starostlivosti o pacienta, liečeného pre zhubný nádor ORL oblasti, zabezpečujúcu jeho výživu a hydratáciu s priaznivou kvalitou života.
Po ukončení liečby a odoznení dysfágie pacienti sledovanej skupiny začali postupne prijímať stravu per os. PEG sme odstránili väčšine chorých po 4 až 6 mesiacoch od ukončenia liečby. Podmienkou bola remisia ochorenia, potvrdená CT a ORL vyšetrením, a Karnofského výkonnostný stav ≥ 90. U žiadneho z týchto pacientov sme nezaznamenali poruchy prehĺtania, spôsobené atrofiou prehĺtacieho svalstva, alebo neskoré pažerákové striktúry, na ktoré upozorňujú Chen a spol. (2). U pacientov s perzistenciou rozsiahlych nádorov sme PEG ponechali trvale.
ZÁVER
Profylaktická aplikácia perkutánnej endoskopickej gastrostómie pred chemorádioterapiou u chorých s pokročilými nádormi hlavy a krku je jednoduchý a bezpečný spôsob, redukujúci nežiaduce prerušenia liečby, zabezpečujúci enterálnu výživu a hydratáciu. Nenáročná obsluha PEG v domácom prostredí umožňuje mnohým chorým ambulantnú formu liečby. Keď pokročilý stav zhubného ochorenia vyžaduje ponechať PEG natrvalo, zachováva táto forma výživy priaznivú kvalitu života liečených. Ako podotýka Pála v závere Komentára k článku Orální komplikace rádioterapie v The Lancet Oncology (13), podporná liečba by nemala končiť zabuchnutím dverí ožarovne po poslednej frakcii žiarenia, aj keď je nutné pritom prekonávať obmedzenia, dané vlastným autodeštrukčným štýlom života väčšiny liečených.
MUDr. Eva
Hajtmanová, Ph.D.
Onkologické
centrum, Univerzitná nemocnica Martin
Kollárova
2
036
59 Martin
Slovenská
republika
e-mail:
hajtmanova@unm.sk
Sources
1. Ang, K. K., Trotti, A., Brown, B. W., Garden, A. S., Foote, R. L., Morrison, W. H., Geara, F. B., Klocht, D. W., Goepfert, H., Peters, L. J.: Randomized trial addressing risk features and time factors of surgery plus radiotherapy in advanced head-and-neck cancer. Int. J. Radiat. Oncol. Biol. Phys., 51, 2001, 3, s. 571-578.
2. Chen, A. M., Li, B. Q., Lau, D. H., Farwell, D. G., Luu, Q., Stuart, K., Newman, K., Purdy, J. A., Vijayakumar, S.: Evaluating the role of prophylactic gastrostomy tube placement prior to definitive chemoradiotherapy for head and neck cancer. Int. J. Radiat. Oncol. Biol. Phys., 78, 2010, 4, s. 1026-1032.
3. Connor, N. P., Cohen, S. B., Kammer, R. E., Sullivan, P. A., Brewer, K. A., Hong, T. S., Chappell, R. J., Harari, P. M.: Impact of conventional radiotherapy on healt-related quality of life and critical functions of the head and neck. Int. J. Radiat. Oncol. Biol. Phys., 65, 2006, 4, s. 1051-1062.
4. Corvó, R.: Evidence-based radiation oncology in head and neck squamous cell carcinoma. Radiother. Oncol., 85, 2007, 1, s. 156-170.
5. Hujala, K., Sipilä, J., Pulkkinen, J., Grenman, R.: Early percutaneous endoscopic gastrostomy nutrition in head and neck cancer patients. Acta Otolaryngol., 124, 2004, 7, s. 847-850.
6. Hynková, L., Doleželová, H.: Nežádoucí účinky rádioterapie a podpůrná léčba u rádioterapie nádorů hlavy a krku. Onkologie, 2, 2008, 2, s. 88-90.
7. Idowu, O., Driggs, X. A., Kim, S.: Laparoscopically assisted antegrade percutaneous endoscopic gastrostomy. J. Pediatr. Surg., 45, 2010, 1, s. 277-279.
8. Jensen, A. R., Nelleman, H. M., Overgaard, J.: Tumor progression in waiting time for radiotherapy in head and neck cancer. Radiother. Oncol., 84, 2007, 1, s. 5-10.
9. Lee, J. H., Machtay, M., Unger, L. D., Weinstein, G. S., Weber, R. S., Chalian, A. A., Rosenthal, D. I.: Prophylactic gastrostomy tubes in patients undergoing intensive irradiation for cancer of the head and neck. Arch. Otolaryngol. Head Neck Surg., 124, 1998, 8, s. 871-875.
10. Mechl, Z., Smilek, P., Červená, R.: Současná strategie léčby karcinomů ORL oblasti. Klin. Onkol., 21, 2008, 2, s. 45-51.
11. Morton, R. P., Crowder, V. L., Mawdsley, R., Ong, E., Izzard, M.: Elective gastrostomy, nutritional status and quality of life in advanced head and neck cancer patients receiving chemoradiotherapy. ANZ J. Surg., 79, 2009, 10, s. 713-718.
12. Nguyen, N. P., North, D., Smith, H. J., Dutta, S., Alfieri, A., Karlsson, U., Lee, H., Martinez, T., Lemanski, C., Nguyen, L. M., Ludin, A., Sallah, S.: Safety and effectivenes of prophylactic gastrostomy tubes for head and neck cancer patients undergoing chemoradiation. Surg. Oncol., 15, 2006, 4, s. 199-203.
13. Pála, M.: Komentář. Lancet Oncol., české vydání, 5, 2006, 2, s. 160.
14. Petera, J., Odrážka, K., Zouhar, M. et al.: Principy radioterapie. In: Šlampa, P., Petera, J. et al. Radiační onkologie. Praha, Galén Karolinum, 2007, s. 11-65.
15. Rutter, C. E., Yovino, S., Taylor, R. et al.: Early PEG tube placement improves nutritional status and decreases hospitalization in head and neck cancer patients receiving definitive chemoradiation. Int. J. Radiat. Oncol. Biol. Phys., 75, 2009, 3, (Suppl.), s. S123-S133.
16. Saarilahti, K., Kajanti, M., Lehtonen, H., Hämäläinen, T., Joensuu, H.: Repopulation during radiotherapy for T1 glottic cancer. Radiother. Oncol., 47, 1998, 2, s. 155-159.
17. Suwinski, R., Sowa, A., Rutkowski, T., Wydmanski, J., Tarnawski, R., Maciejewski, B.: Time factor in postoperative radiotherapy: a multivariate locoregional control analysis in 868 patients. Int. J. Radiat. Oncol. Biol. Phys., 56, 2003, 2, s. 399-412.
18. Šachlová, M.: Výživa onkologických pacientů. Klin. Onkol., 16, 2003, 2, s. 77-79.
19. Šlampa, P., Soumarová, R., Kocáková, I. et al.: Konkomitantní chemorádioterapie solidních nádorů. Praha, Galén, 2005, 167 s.
20. Wasiková, S., Piskač, P., Spurný, V., Rotnáglová, S.: Perkutánní endoskopická gastrostomie u pacientů s tumory hlavy a krku. Klin. Onkol., 20, 2007, 5, s. 349-353.
21. Zips, D.: Influence of time factor and repopulation on treatment resistance. In: Molls, M., Vaupel, P., Nieder, C., Anscher, M. S.: The impact of tumor biology on cancer treatment and multidisciplinary strategies. Berlin, Springer, 2009, s. 292-296.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)Article was published in
Otorhinolaryngology and Phoniatrics

2011 Issue 1
Most read in this issue
- Lipový B., Řihová H., Kaloudová Y., Jonášek M., Suchánek I., Gregorová N., Brychta P.: Inhalation Trauma – History, Present and Future
- Krempaská S., Kovaľ J. : Complications after Eardrum Membrane Reconstruction
- Dytrych P., Katra R., Jurovčík M., Karmanová D., Šnajdauf J., Kabelka Z.: Laryngotracheoesophageal Cleft
- Hajtmanová E., Hajtman A., Kinclová I., Muríň P., Lietava P., Hajtman A., Péč M.: Percutaneous Endoscopic Gastrostomy in the Therapy of Patients with Advanced Head and Neck Tumors
