Kavernózní hemangiom temporálního svalu – kazuistika
Haemangioma of the temporal muscle – a case report
The authors present a case report of a 37-year-old female patient seen at the ENT clinic for a soft oval swelling on the left temporal region Intramuscular haemangioma is a rare diagnosis, accounting for only 1% of all haemangiomas. Only 34 cases of intramuscular haemangioma of the temporal muscle have been described in the world literature. In the case report, the authors describe the diagnostic process, surgical procedure, other therapeutic options, and the follow-up of the patient.
Keywords:
intramuscular hemangioma – temporal muscle – preoperative embolization – surgical extirpation
Authors:
Hana Schovánková
; Richard Salzman
Authors‘ workplace:
Klinika otorinolaryngologie a chirurgie hlavy a krku LF UP a FN Olomouc
Published in:
Otorinolaryngol Foniatr, 73, 2024, No. 1, pp. 48-52.
Category:
Case Reports
doi:
https://doi.org/10.48095/ccorl202448
Overview
Autoři v kazuistice prezentují případ kavernózního hemangiomu temporálního svalu u 37leté pacientky, která byla na ORL ambulanci vyšetřena pro měkké, oválné, nebolestivé zduření temporální oblasti vlevo. Intramuskulární hemangiom je vzácné onemocnění, které tvoří přibližně 1 % všech hemangiomů. Ve světové literatuře bylo doposud popsáno pouze 34 případů tohoto onemocnění. Diskutována je symptomatologie, patofyziologie, diagnostika a terapeutický postup.
Klíčová slova:
intramuskulární hemangiom – temporální sval – předoperační embolizace – chirurgická exstirpace
Úvod
Hemangiom je benigní vaskulární léze projevující se abnormální proliferací krevních cév. Tvoří okolo 7 % všech benigních nádorů měkkých tkání [1]. Existují dva základní typy hemangiomů – kongenitální a infantilní. Infantilní hemangiom nemusí být při narození dobře patrný a k jeho růstu dochází postnatálně, zatímco typ kongenitální vzniká již prenatálně [2]. Etiologie onemocnění není v současné době ani v jednom případě spolehlivě vysvětlena [3]. Předpokládá se, že významnou roli v patogenezi onemocnění může hrát aberantní proliferace, diferenciace a migrace pluripotentní progenitorové buňky do míst, kde je umožněn růst tkáně podobné placentě [3].
Podle typu cév tvořících hemangiom můžeme rozlišovat typ kapilární, kavernózní nebo smíšený. Hemangiomy se typicky vyskytují na kůži a sliznicích, mohou však postihovat všechny vaskularizované tkáně včetně svalů a kostí. Intramuskulární hemangiomy tvoří asi 0,8 % všech hemangiomů, z toho se 10–15 % z nich vyskytuje v kosterní svalovině oblasti hlavy a krku [4]. Nejčastějším místem postižení je m. masseter nebo m. trapezius [5]. Ve světové literatuře bylo do března 2022 evidováno pouze 34 případů intramuskulárního hemangiomu temporálního svalu [4].
Kazuistika
Do všeobecné otorinolaryngologické ambulance se dostavila 37letá žena pro 9 měsíců trvající zduření v levé temporální krajině. Jednalo se o nebolestivou, intermitentně pulzující a postupně se zvětšující rezistenci. Pacientka byla nekuřačka, trauma v oblasti hlavy a krku neprodělala, jiná interní onemocnění neudávala.
Při fyzikálním vyšetření byla nad levým jařmovým obloukem nalezena měkká, pohyblivá rezistence o velikosti přibližně 2 × 2 cm. Kůže nad rezistencí byla normálního vzhledu, bez zarudnutí či fluktuace. Nad lézí nebyla zaznamenána pulzace. Patologicky zvětšené regionální lymfatické uzliny nebyly hmatné.
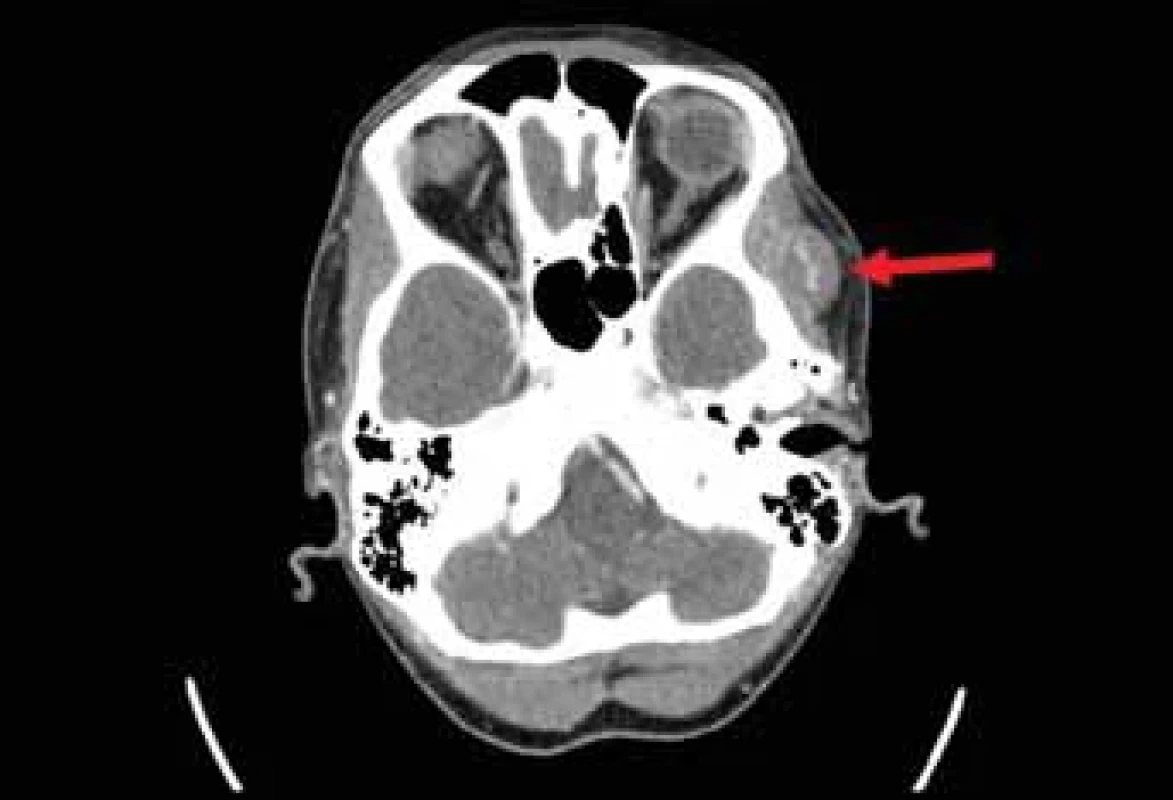
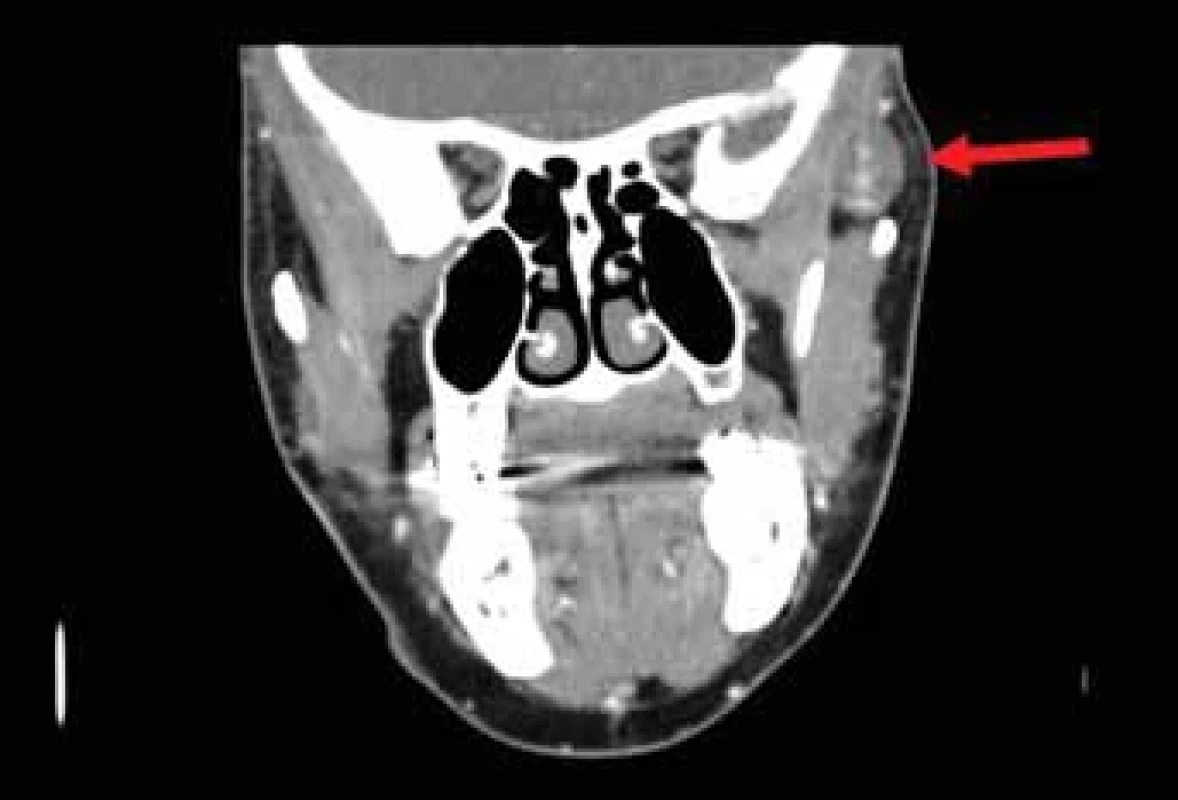
Následně bylo provedeno vyšetření na počítačové tomografii (CT) s podáním kontrastní látky, které odhalilo ovoidní ložisko o velikosti 19 × 14 × 18 mm lokalizované při temporálním svalu vlevo (obr. 1, 2). Útvar byl dobře ohraničený a obsahoval množství cév. Na základě tohoto nálezu byla stanovena pracovní diagnóza kavernózního hemangiomu. Aspirační biopsie tenkou jehlou nebyla pro bohatou vaskularizaci provedena.
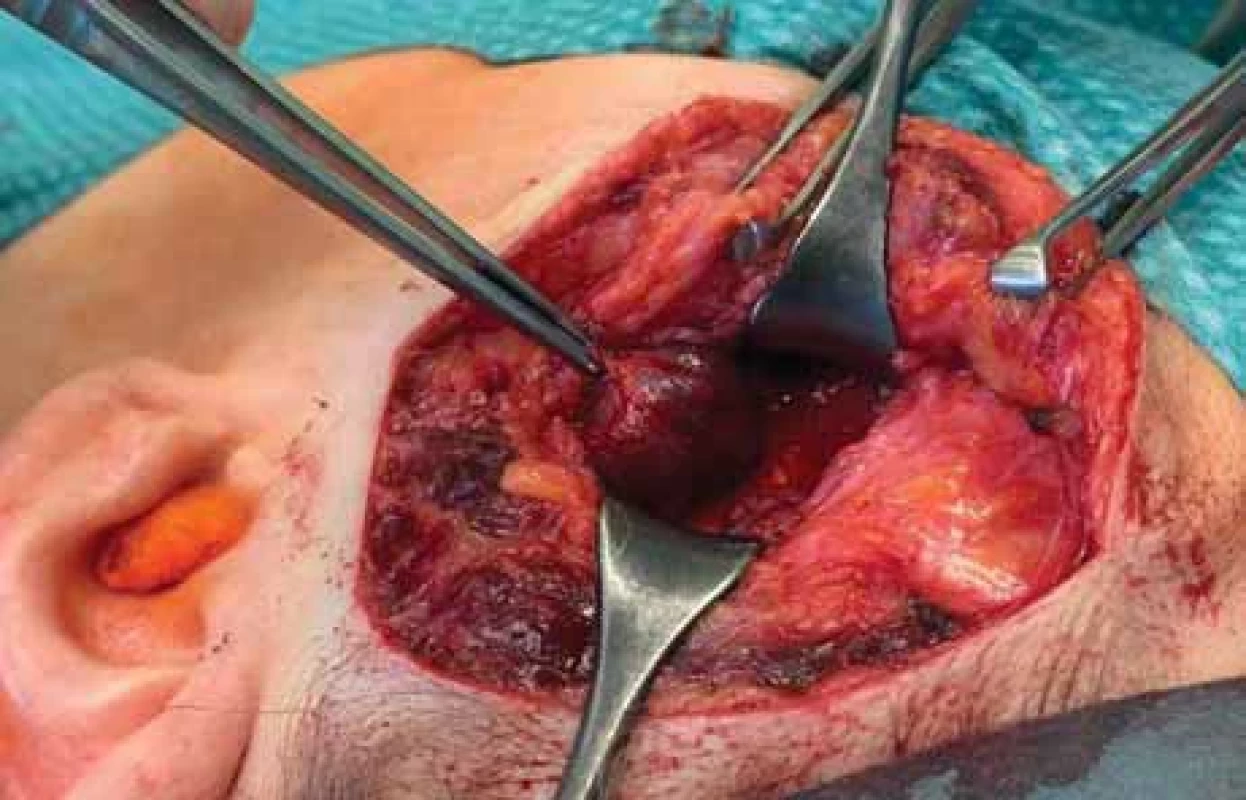
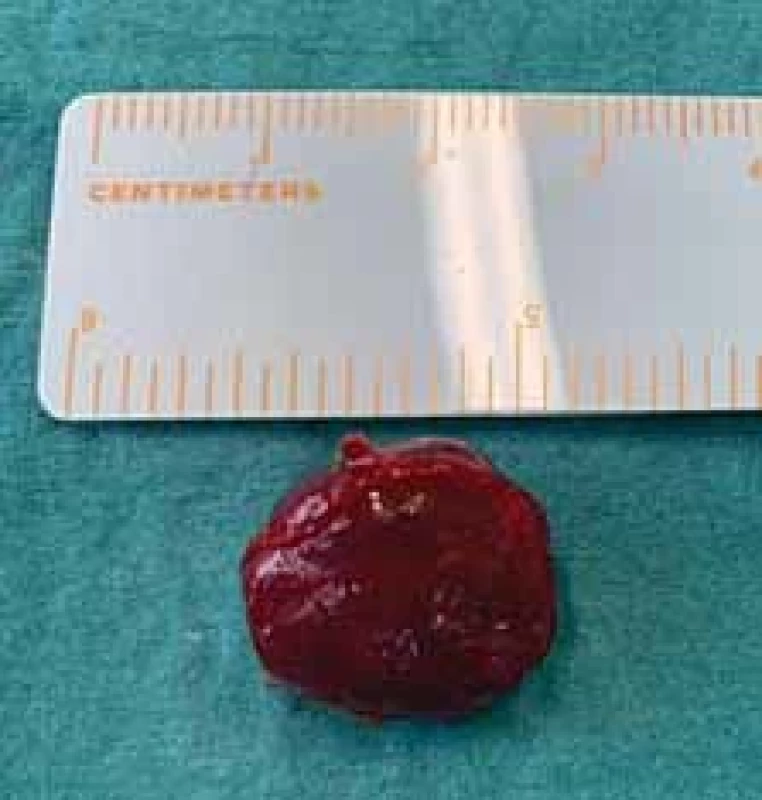
Poté bylo přistoupeno k chirurgické exstirpaci tumoru v celkové anestezii. S ohledem na riziko poranění temporálních a zygomatických větví lícního nervu (n. VII) byla použita neurostimulace. Pacientka byla operována v supinační poloze s rotací hlavy doprava. Incize byla vedena při hranici vlasaté části hlavy s prodloužením řezu preaurikulárně. Byla vypreparována a následně protnuta temporální fascie (obr. 3). Poté byla nalezena měkkotkáňová struktura lividní barvy o velikosti 20 × 20 mm vzhledu hemangiomu (obr. 4). Útvar parciálně zasahoval do oblasti infratemporální jámy. Během výkonu byly identifikovány a chráněny periferní větve n. VII. Pooperační průběh byl bez komplikací, pacientka byla propuštěna druhý pooperační den do domácí péče. Histologické vyšetření následně definitivně potvrdilo diagnózu kavernózního hemangiomu. Dva měsíce po operaci nebyly pozorovány známky lokální recidivy.
Diskuze
Intramuskulární hemangiomy jsou vzácné benigní tumory vaskulárního endotelu. Klinicky se obvykle projevují jako dobře ohraničené, pomalu rostoucí léze, které jsou při palpaci volně pohyblivé, většinou nebolestivé. Případnou bolestivost může nejčastěji vyvolat sekundární infekce následkem úrazu. V diferenciální diagnostice je zvažován např. lymfangiom, lymfom, neurofibrom, lipom, dermoidní cysta, patologicky zvětšená lymfatická uzlina, sarkom měkkých tkání nebo temporální arteritida [6, 7]. K posouzení charakteru léze, vztahu k okolním strukturám a odlišení od ostatních nádorů měkkých tkání je ze zobrazovacích metod využíváno ultrasonografie, CT, CT angiografie a magnetická rezonance (MR). Při předpokladu vaskulární povahy nádoru je metodou volby MR [8–10]. Na T1 váženém zobrazení jsou hemangiomy izointenzivní nebo hypointenzivní vůči svalu. Při zobrazení v T2 váženém obraze jsou léze hyperintenzivní pro objem stagnující krve [11].
U vaskularizovaných tumorů obvykle doplňujeme CT angiografii k ozřejmění hlavních přívodných cév. Angiografie poskytuje nejen informace o cévním zásobení samotného nádoru, ale i znalost o cévním řečišti v okolí, což je v rámci procesu plánování chirurgického výkonu velmi přínosné [12]. Současně s tím je vhodnou doplňkovou léčbou před vlastní chirurgickou resekcí intraarteriální embolizace [12, 13]. Předoperační embolizace u hypervaskularizovaných novotvarů vede ke zlepšení přehlednosti operačního pole, snížení krevních ztrát během operace, usnadnění vlastní resekce tumoru, zkrácení doby operačního výkonu a v konečném důsledku ke snížení morbidity a rizika možné recidivy onemocnění [11, 14, 15].
Před případnou embolizací je nutné věnovat zvláštní pozornost identifikaci cévních anastomóz mezi povodím a. carotis externa a interna. V případě výskytu těchto spojek je předoperační embolizace kontraindikována pro riziko intrakraniální embolizace vedoucí až k cévní mozkové příhodě či k poškození cévního zásobení sítnice s následnou slepotou [12, 16]. Embolizace se obvykle provádí 24–48 hod. před samotnou resekční fází operace. Delší časový odstup by mohl vést k otoku až nekróze tumoru, případně k ischemii přilehlých struktur s jejich následným funkčním poškozením [12].
V našem případě jsme provedli CT vyšetření, které prokázalo vaskularizovaný tumor nad temporálním svalem. Tento nález nás vedl ke stanovení pracovní diagnózy hemangiomu. Lézi jsme hodnotili jako chirurgicky dobře přístupnou a vzhledem k velikosti tumoru jsme neočekávali významnou krevní ztrátu, proto jsme nepřistoupili ke zvažované předoperační embolizaci.
Předoperační stanovení diagnózy intramuskulárního hemangiomu může být obtížné zejména pro nespecifickou klinickou manifestaci a vzácný výskyt v oblasti hlavy a krku. Literárně se uvádí, že shoda mezi pracovní a definitivní histopatologickou diagnózou byla pouze v 8 % případů [17]. V rámci předoperační diagnostiky rezistencí v oblasti hlavy a krku je často využíváno metod miniinvazivní biopsie, jako je aspirační biopsie tenkou jehlou (FNAB) nebo biopsie pomocí core needle (CNB). Tyto diagnostické metody se na našem pracovišti standardně provádí pod sonografickou kontrolou. FNAB se dá využít k biopsii téměř všech lézí v ORL oblasti, limitací je však následné cytologické zpracování vzorku, pří kterém není možné ověřit buněčnou architekturu vzorku [18]. Část lézí zůstává po FNAB nediagnostikována pro nedostatečné množství odebraného materiálu [19]. Výtěžnost vyšetření zaleží na zkušenostech lékaře, který biopsii provádí, a zejména pak patologa, který vzorek odečítá [20–22]. Převažují však názory, že provedení FNAB nebo CNB je v případě hypervaskularizovaných lézí pro vysoké riziko krvácení relativní kontraindikací, a v klinické praxi se proto rutinně neprovádí [20–24].
Mezi další možnosti terapie kavernózního hemangiomu patří systémová farmakoterapie, která je preferována u kojenců [3]. Zde je lékem volby propanolol, což je neselektivní blokátor betaadrenergních receptorů, který způsobuje vazokonstrikci, inhibuje angiogenezi, snižuje hladinu matrix metaloproteináz a interleukinu 6 [3]. Dříve se v léčbě hemangiomů využívalo rovněž systémově podávaných kortikosteroidů, od čehož se celosvětově v posledních letech ustupuje. Případná dlouhodobá terapie kortikosteroidy s následným kumulativním efektem zvyšuje riziko nežádoucích účinků [3, 25]. Dalšími terapeutickými možnostmi jsou kryoterapie, sklerotizace, embolizace či chirurgická terapie [3, 25, 26].
Způsob léčby závisí na lokalizaci hemangiomu, rozsahu infiltrace, rychlosti růstu, klinických příznacích a v neposlední řadě na věku, celkovém stavu a preferencích pacienta. Mezi další možnosti léčby patří také prosté sledování. V těchto případech je však nutné pacienta pečlivě poučit o významu pravidelných kontrol. Observace je nejčastěji doporučována u dětí s malými hemangiomy, u nichž je relativně vysoká pravděpodobnost spontánní regrese až úplného vymizení.
Přestože jsou hemangiomy svou histopatologickou povahou benigní léze, při progresi velikosti mohou způsobovat kosmetické, ale i funkční potíže. V případě naší pacientky by další progrese tumoru mohla vést k rozvoji léze zygomatické nebo temporální větve n. VII. Právě riziko poruchy funkce n. VII nás vedlo k plánování časného chirurgického zákroku. Sharma et al. uvádějí, že včasná chirurgická resekce vede ke snížení počtu komplikací (poruchy funkce n. VII, intraoperační krvácení, snížení rizika vzniku recidivy) a také k zachování integrity svalu [27]. Pokud však rizika resekce tumoru převyšují benefity z jeho odstranění, je preferováno pouze pravidelné sledování.
Chirurgický přístup se liší dle lokalizace a velikosti léze. V našem případě jsme provedli incizi v okraji vlasaté části hlavy, která nám umožnila dostatečnou expozici operačního pole a identifikaci tepenného zásobení tumoru s jeho následným podvazem. Novotvar byl exstirpován in toto bez poranění lícního nervu. V literatuře je rovněž doporučován postup chirurgické excize spolu s lemem zdravé tkáně svalu pro snížení rizika výskytu lokální recidivy [6, 8]. V případě, že není možné provést exstirpaci samotného tumoru, je rovněž doporučeno odstranit celý sval spolu s hemangiomem. V našem případě byl úvar dobře ohraničený a na temporální sval nasedal pouze malou stopkou, proto nebylo nutné přistoupit k excizi okraje zdravé tkáně svalu.
Dle literatury dochází k recidivě intramuskulárního hemangiomu až ve 28 % případů. V případě probíhajícího kolaterálního zánětu dochází k přijizvení tumoru k okolí, a je tedy riziko recidivy hemangiomu po exstirpaci vyšší. Míra recidivy záleží i na velikosti, ohraničení tumoru a typu vaskulární léze. Kapilární hemangiom recidivuje častěji, je agresivnější a rychleji rostoucí ve srovnání v hemangiomem kavernózním [8]. Pro riziko recidivy je důležitá dispenzarizace pacientů, u naší pacientky je v plánu dispenzarizace po dobu 2 let.
Závěr
Hemangiomy jsou nezhoubné novotvary, které se řadí mezi mezenchymové nádory krevních cév. Většinou se vyskytují na kůži a v podkoží, ale mohou se vyskytnout i ve vnitřních orgánech a svalech. Intramuskulární hemangiomy jsou vzácné léze a je nutno na ně pomýšlet v diferenciální diagnostice patologických rezistencí v oblasti hlavy a krku. K diagnostice využíváme zobrazovací metody, postačující je v tomto případě využití ultrasonografie a počítačové tomografie s kontrastní látkou. Dobře ohraničené tumory lze odstranit chirurgickou exstirpací, v případě plošných lézí nasedajících široce na sval se chirurgická resekce rozšiřuje o lem zdravé tkáně svalu. Progresivní růst léze může způsobit vážné funkční a kosmetické potíže.
Prohlášení o střetu zájmu
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Grantová podpora
Podpořeno MZ ČR – RVO (FNOL, 00098892) a IGA LF UPOL 2023-08.
Sources
1. Wierzbicki JM, Henderson JH, Scarborough MT et al. Intramuscular hemangiomas. Sports Health 2013; 5 (5): 448–454. Doi: 10.1177/194173 8112470910.
2. Leaute-Labreze C, Harper JI, Hoeger PH. Infantile haemangioma. Lancet 2017; 390 (10089): 85–94. Doi: 10.1016/S0140-6736 (16) 00645-0.
3. Třešňák Hercogová J. Klinická dermatovenerologie. Praha: Mladá fronta 2019.
4. Alqahtani AA, AlQarni AA, Abbas MM et al. Temporal Muscle Cavernous Hemangioma: A Case Report and Literature Review. Cureus 2022; 14 (3): e23166. Doi: 10.7759/cureus.23166.
5. Wolf GT, Daniel F, Krause CJ et al. Intramuscular hemangioma of the head and neck. Laryngoscope 1985; 95 (2): 210–213. Doi: 10.1288/00 005537-198502000-00018.
6. To EW, Tsang W, Pang PC et al. Cavernous hemangioma of the temporalis muscle: report of a case. J Oral Maxillofac Surg 2001; 59 (10): 1229–1232. Doi: 10.1053/joms.2001.26733.
7. Bui-Mansfield LT, Myers CP, Fellows D et al. Bilateral temporal fossa hemangiomas. AJR Am J Roentgenol 2002; 179 (3): 790. Doi: 10.2214/ajr.179.3.1790790.
8. Heckl S, Aschoff A, Kunze S. Cavernous hemangioma of the temporal muscle. Neurosurg Rev 2002; 25 (1–2): 63–67. Doi: 10.1007/s101430100 181.
9. van Rijswijk CS, van der Linden E, van der Woude HJ et al. Value of dynamic contrast-enhanced MR imaging in diagnosing and classifying peripheral vascular malformations. AJR Am J Roentgenol 2002; 178 (5): 1181–1187. Doi: 10.2214/ajr.178.5.1781181.
10. Baker LL, Dillon WP, Hieshima GB et al. Hemangiomas and vascular malformations of the head and neck: MR characterization. AJNR Am J Neuroradiol 1993; 14 (2): 307–314.
11. American Society of I, Therapeutic N. Head, neck, and brain tumor embolization. AJNR Am J Neuroradiol 2001; 22 (8 Suppl): S14–S15.
12. Lazzaro MA, Badruddin A, Zaidat OO et al. Endovascular embolization of head and neck tumors. Front Neurol 2011; 2: 64. Doi: 10.3389/fneur.2011.00064.
13. Kalhous J, Sláma K. Hemangiom paranazálních dutin (kazuistika). Otorinolaryngol Foniatr 2003; 52 (2): 95–97.
14. Gupta R, Thomas AJ, Horowitz M. Intracranial head and neck tumors: endovascular considerations, present and future. Neurosurgery 2006; 59 (5 Suppl 3): S251–S213. Doi: 10.1227/01.NEU.0000239249.65742.1C.
15. Gupta AK, Purkayastha S, Bodhey NK et al. Preoperative embolization of hypervascular head and neck tumours. Australas Radiol 2007; 51 (5): 446–452. Doi: 10.1111/j.1440-16 73.2007.01869.x.
16. Šercl M, Šerclová V, Havrdová H et al. Embolizační léčba epistaxí. Otorinolaryngol Foniatr 2019; 68 (2): 79–85.
17. Giudice M, Piazza C, Bolzoni A et al. Head and neck intramuscular haemangioma: report of two cases with unusual localization. Eur Arch Otorhinolaryngol 2003; 260 (9): 498–501. Doi: 10.1007/s00405-003-0626-7.
18. Ahmad T, Naeem M, Ahmad S et al. Fine needle aspiration cytology (FNAC) and neck swellings in the surgical outpatient. J Ayub Med Coll Abbottabad 2008; 20 (3): 30–32.
19. Nyquist GG, Tom WD, Mui S. Automatic core needle biopsy: a diagnostic option for head and neck masses. Arch Otolaryngol Head Neck Surg 2008; 134 (2): 184–189. Doi: 10.1001/archoto. 2007.39.
20. Salzman R, Buchanan MA, Berman L et al. Ultrasound-guided core-needle biopsy and magnetic resonance imaging in the accurate diagnosis of intramuscular haemangiomas of the head and neck. J Laryngol Otol 2012; 126 (4): 391–394. Doi: 10.1017/S0022215111003161.
21. Colakoglu O, Taskiran B, Yazici N et al. Safety of biopsy in liver hemangiomas. Turk J Gastroenterol 2005; 16 (4): 220–223.
22. Cho JK, Cha W, Sung MW. Intramuscular Hemangioma in the Anterior Scalene Muscle Diagnosed by Core Needle Biopsy. Clin Exp Otorhinolaryngol 2015; 8 (3): 298–301. Doi: 10.3342/ceo.2015.8.3.298.
23. Huang T, Pope SJ, Volpe JP et al. Pulmonary capillary hemangioma diagnosed by needle core biopsy: Case report and review of the literature. Human Pathology: Case Reports 2017; 9: 50–54. Doi: 10.1016/j.ehpc.2016.09.004.
24. Heilo A, Stenwig AE. Liver hemangioma: US- -guided 18-gauge core-needle biopsy. Radiology 1997; 204 (3): 719–722. Doi: 10.1148/radiology.204.3.9280249.
25. Zheng JW, Zhang L, Zhou Q et al. A practical guide to treatment of infantile hemangiomas of the head and neck. Int J Clin Exp Med 2013; 6 (10): 851–860.
26. Zheng JW, Zhou Q, Yang XJ et al. Treatment guideline for hemangiomas and vascular malformations of the head and neck. Head Neck 2010; 32 (8): 1088–1098. Doi: 10.1002/hed.21274.
27. Sharma BS, Chari PS, Joshi K et al. Hemangioma of the temporalis muscle. Ann Otol Rhinol Laryngol 1991; 100 (1): 76–78. Doi: 10.1177/000348949110000113.
ORCID autorů
Přijato k recenzi: 7. 3. 2023
Přijato k tisku: 25. 8. 2023
doc. MUDr. Richard Salzman, Ph.D.
Klinika otorinolaryngologie a chirurgie hlavy a krku
LF UP a FN Olomouc
Zdravotníků 248/7
779 00 Olomouc
richard.salzman@fnol.cz
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)Article was published in
Otorhinolaryngology and Phoniatrics
2024 Issue 1
Most read in this issue
- Přínos tenkojehlové aspirační biopsie a klasifikace Bethesda v diagnostice tumorů štítné žlázy – retrospektivní studie
- PFAPA syndróm u detí, naša skúsenosť s chirurgickou liečbou – prehľadový článok s kazuistikou
- Netuberkulózní mykobakteriální infekce v dětském věku
- Kavernózní hemangiom temporálního svalu – kazuistika
