Inhalační trauma – historie, současnost a budoucnost
Lipový B., Řihová H., Kaloudová Y., Jonášek M., Suchánek I., Gregorová N., Brychta P.: Inhalation Trauma – History, Present and Future
Inhalation trauma is defined as an acute affection of respiratory pathways caused by inhalation of burning products or steam. It also develops during irritation of respiratory pathways by various chemicals. The global interest in inhalation trauma was triggered by the tragic event in 1942 when 492 prevailingly young people died mostly as a consequence of inhalation trauma during the fire in a night club. The evolution of the care of patients with inhalation trauma underwent dramatic changes over the last 60 years (advances in early diagnostics of inhalation trauma, securing the respiratory pathways, correctly indicated lung ventilation and, especially, precise microbiologic surveillance not limited to the area of respiratory pathways) which significantly improved the chances for survival in patients with this type of damage. The review has been composed as the basic information guide to history, presence and vision into the future care of patients with inhalation trauma, approach to the diagnostics and therapy.
Key words:
inhalation trauma, diagnostics, therapy
Autoři:
B. Lipový 1,2; H. Řihová 1; Y. Kaloudová 1; M. Jonášek 3; I. Suchánek 1; N. Gregorová 1; P. Brychta 1,2
Působiště autorů:
Klinika popálenin a rekonstrukční chirurgie FN Brno
1; Lékařská fakulta Masarykovy Univerzity, Brno
2; Klinika anesteziologie, resuscitace a intenzivní medicíny FN Brno
3
Vyšlo v časopise:
Otorinolaryngol Foniatr, 60, 2011, No. 1, pp. 51-57.
Kategorie:
Přehledový článek
Souhrn
Inhalační trauma je definováno jako akutní postižení dýchacích cest způsobené inhalací produktů hoření nebo páry. Vzniká také při iritaci dýchacích cest různými chemickými látkami. Celosvětový zájem o inhalační trauma vzbudila až tragická událost z roku 1942, kdy při požáru v nočním klubu v Bostonu zemřelo 492 mladých lidí, převážně v důsledku inhalačního traumatu. Vývoj péče o pacienty s inhalačním traumatem prodělal za posledních 60 let dramatické změny (pokroky v časné diagnostice inhalačního traumatu, zajištění dýchacích cest, správně indikované umělé plicní ventilace a zejména precizní mikrobiologické surveillance nejen v oblasti dýchacích cest), které významně zlepšily šance na přežití pacientů s tímto typem poranění. Přehledový článek je koncipován jako základní informační průvodce historií, přítomností a vizí do budoucna péče o pacienty s inhalačním traumatem. Nosným tématem jsou současné poznatky o patofyziologii inhalačního traumatu, přístupu k jeho diagnostice a terapii.
Klíčové slova:
inhalační trauma, diagnostika, terapie.
HISTORIE
Do 40. let minulého století se inhalačnímu traumatu nevěnovala prakticky žádná pozornost. Rozsáhle popálení pacienti umírali pod obrazem popáleninového šoku. Celosvětový zájem o diagnostiku a terapii inhalačního traumatu odstartovala až katastrofa v „Cocoanut Groove“ v Bostonu z 28. listopadu 1942. (29). Tehdy v nočním klubu zemřelo zejména následkem inhalačního traumatu 492 převážně mladých lidí a dalších 166 bylo zraněno. Tato katastrofa představuje druhý nejsmrtelnější požár v americké historii. Tato tragédie na pár dní nahradila v čele novinových titulků 2. světovou válku. Samotný požár vedl k reformě bezpečnostních a požárních předpisů. V osudný večer bylo v klubu více než 1000 lidí, i když jeho kapacita byla pouze 460 lidí. Požár začal v 22:15, když při výměně žárovky došlo ke vznícení umělých palmových listů v klubu. Oheň se velmi rychle rozšířil. Hlavním a jediným únikovým východem byly nevelké otočné dveře, které se záhy v panice zablokovaly. Více než 500 lidí, kteří požár přežili, patřilo k prvním, u kterých se objevila a následně zkoumala posttraumatická stresová porucha (5). V roce 1993 byl na cihlovou půdu v Piedmont Street, kde dříve klub stál, postaven památník události (24).
DEFINICE
Inhalační trauma je definováno jako akutní postižení dýchacích cest způsobené inhalací produktů hoření nebo páry. Může se vyvinout také jako důsledek inhalace chemických iritancií (20). V horních dýchacích cestách převládá termické postižení, které se manifestuje otokem a obstrukcí, v dolních dýchacích cestách, kde už díky regulačním mechanismům není teplota inhalované směsi tak vysoká, dominuje chemická iritace (33). Na inhalační trauma je nutno myslet vždy, pokud jsou popáleniny lokalizovány v oblasti hlavy a krku, pokud jsou přítomny saze v ústní či nosní dutině, nebo pacient saze vykašlává a má subjektivní potíže, jako zhoršené polykání. Přítomen bývá také často chrapot či stridor. I samotné inhalační trauma může mít pro pacienty fatální následky, ovšem pokud se vyskytne jako komplikace popálení, vždy prognózu pacienta zhoršuje (25). Vliv jednotlivých typů poranění na mortalitu je znázorněn v tabulce 1.

Vývoj péče o pacienty s inhalačním traumatem prodělal za posledních 60 let řadu dramatických změn (pokroky v časné diagnostice inhalačního traumatu, zajištění dýchacích cest, správně indikované umělé plicní ventilace a zejména precizní mikrobiologické surveillance nejen v oblasti dýchacích cest), které významně zlepšily šance na přežití pacientů s tímto typem poranění.
Incidence
Inhalační trauma je přítomno u každého třetího pacienta přijatého pro těžké termické trauma. Výskyt inhalačního traumatu se zvyšuje s nárůstem rozsahu popálené plochy. Zatímco u pacientů s rozsahem popálené plochy pod 10 % TBSA (total body surface area) se pohybuje okolo 5 %, u pacientů s rozsahem nad 80 % TBSA je výskyt inhalačního traumatu až v 85 % (21). Výskyt inhalačního traumatu u pacientů, přijatých na JIP Kliniky popálenin a rekonstrukční chirurgie FN Brno v období 1. ledna 2005 do 31. prosince 2009, je znázorněn v tabulce 2. Za toto období bylo celkem přijato 281 dospělých pacientů. U 103 (36,66 %) pacientů bylo diagnostikováno inhalační trauma.

Patofyziologie
Obecně platí, čím je inhalovaná částice větší a více hydrofilní, tak se deponuje v dýchacích cestách více orálněji (nazálnějí) a naopak, tedy velikost částic je velmi důležitá z hlediska predikce místa maximálního postižení. Inhalované částice větší než 10 mikrometrů jsou retinovány v nosní dutině a nasopharyngu, částice o velikosti 3-10 mikrometrů v tracheobronchiálním stromu. Partikule o velikosti 1-2 mikrometry poté prostupují až k alveolům. Ještě menší částice, vstupující do dýchacích cest, mohou být exhalovány bez ovlivnění dýchacích cest či jiných orgánů (20). Plyny hůře rozpustné ve vodě prostupují snáze alveolokapilární membránou a jejich účinek může být poté generalizován. Základní rozdělení inhalačního traumatu dle lokalizace nabízí tabulka 3.

U pacientů dochází k postupné elevaci mediátorů jako TNF- α (tumor nekrotizující faktor – alfa) a IL – 6, IL - 8 (interleukin – 6,8) (10). Ovšem nárůst těchto mediátorů je patrný také u pacientů s popálením. Jiná je situace u IL – 7, IL12p70, které regulují funkci T-buněk a jejichž hladiny se výrazně liší u pacientů s inhalačním traumatem a popálením. I když přesná regulace produkce cytokinů u inhalačního traumatu není zatím objasněna, předpokládá se, že určité interleukiny jako IL-6 a IL-7 mohou být potenciálními markery v predikci závažnosti inhalačního traumatu(14). U inhalačního traumatu také dochází ke zvýšené expresi inducibilní syntetázy oxidu dusného (iNOS) a hladin oxidu dusného (NO). Inhalační trauma, postihující oblast plicních alveolů, vede k bezprostřední dysfunkci surfaktantu a tvorbě mikroatelektáz. Zvýšená hladina NO, spolu s absencí adekvátní funkce plicního surfaktantu, poté může způsobit ventilačně/perfuzní nepoměr (Q/V mismatch) a poškození plicního mikrovaskulárního endotelu, které vede k rozvoji plicního edému. NO se stává cytotoxickým a pro-inflamatorním působkem reakcí s kyslíkem za tvorby peroxynitrátu (ONOO-). Peroxinitrát dále poškozuje plicní tkáň (23).
Pacienti s inhalačním traumatem postupují jednotlivými fázemi, které se dají z časového a klinického hlediska rozdělit na častou-resuscitační fázi (neboli fázi akutní plicní insuficience 0-36 hodin od úrazu), dále postresuscitační fází (fázi plicního edému 36-96 hodin od úrazu) a infekční období (bronchopneumonie 3-10 dní od úrazu), které se rozvíjí až u 50 % pacientů (2, 13).
Intaktní respirační trakt disponuje celou řadou mechanismů bránících vstupu infekce. Těmito mechanismy jsou zejména hlasivky jako anatomická bariéra, kašlací reflex, mukociliární transport, buněčná a humorální imunita. Značná část z těchto obranných mechanismů je u pacientů s inhalačním traumatem narušena. Proto patří pacienti s inhalačním traumatem mezi skupinu s nejčastějším rozvojem infekčních komplikací v oblasti dolních dýchacích cest (ventilátorová tracheobronchitida, ventilátorová pneumonie). Incidence ventilátorové pneumonie udává až 35 případů na 1000 ventilační dní (7, 28).
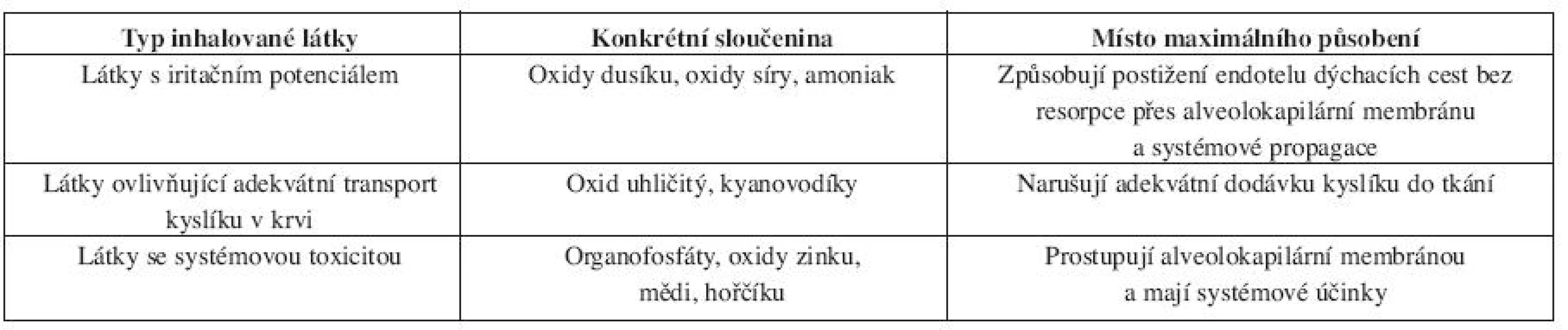
Inhalační trauma se může manifestovat pod různým klinickým obrazem v závislosti na tom, jaká látka je inhalována. Základní rozdělení dle inhalované látky, a tedy klinického obrazu, který lze očekávat, nabízí tabulka 4. Neznamená to ovšem, že by oxid uhelnatý nebo kyanovodík nemohly působit v dýchacích cestách iritačně.
Samotný patofyziologický proces inhalačního traumatu je velmi komplexní a je determinován zejména postiženou oblastí dýchacích cest. Zatímco v orofaryngu dochází k identickému patofyziologickému jevu jako u popálení, v oblasti tracheobronchiální krajiny již dochází k postižení zejména chemickou iritací, protože zde již teplota inspirované směsi většinou nemá potenciál denaturovat bílkoviny. Postižení plicního parenchymu se z patofyziologického hlediska manifestuje postupným snižováním Horowitzova indexu, redukcí compliance a narůstajícím edémem (35).
Diagnostika
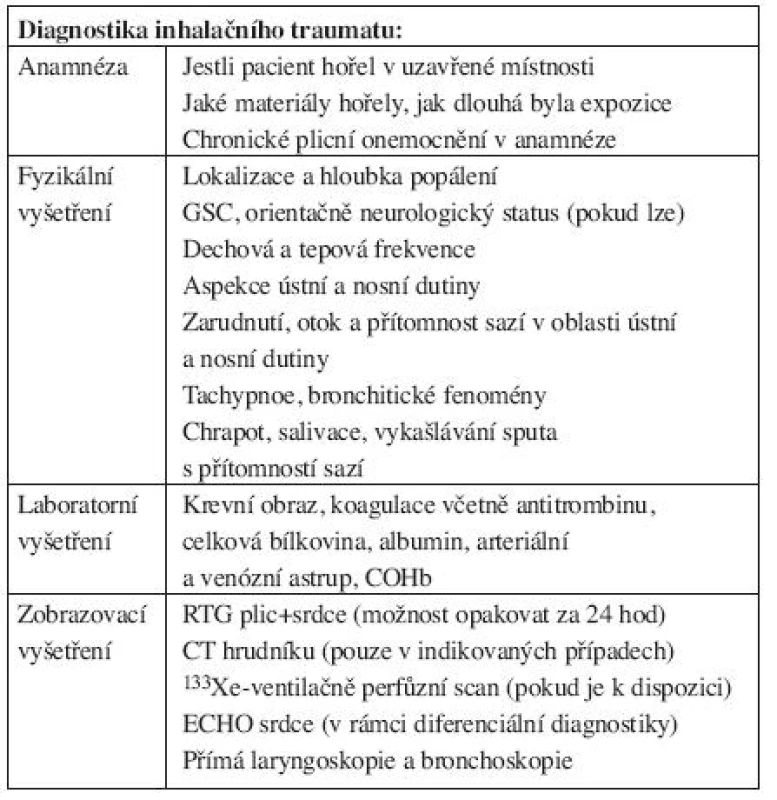
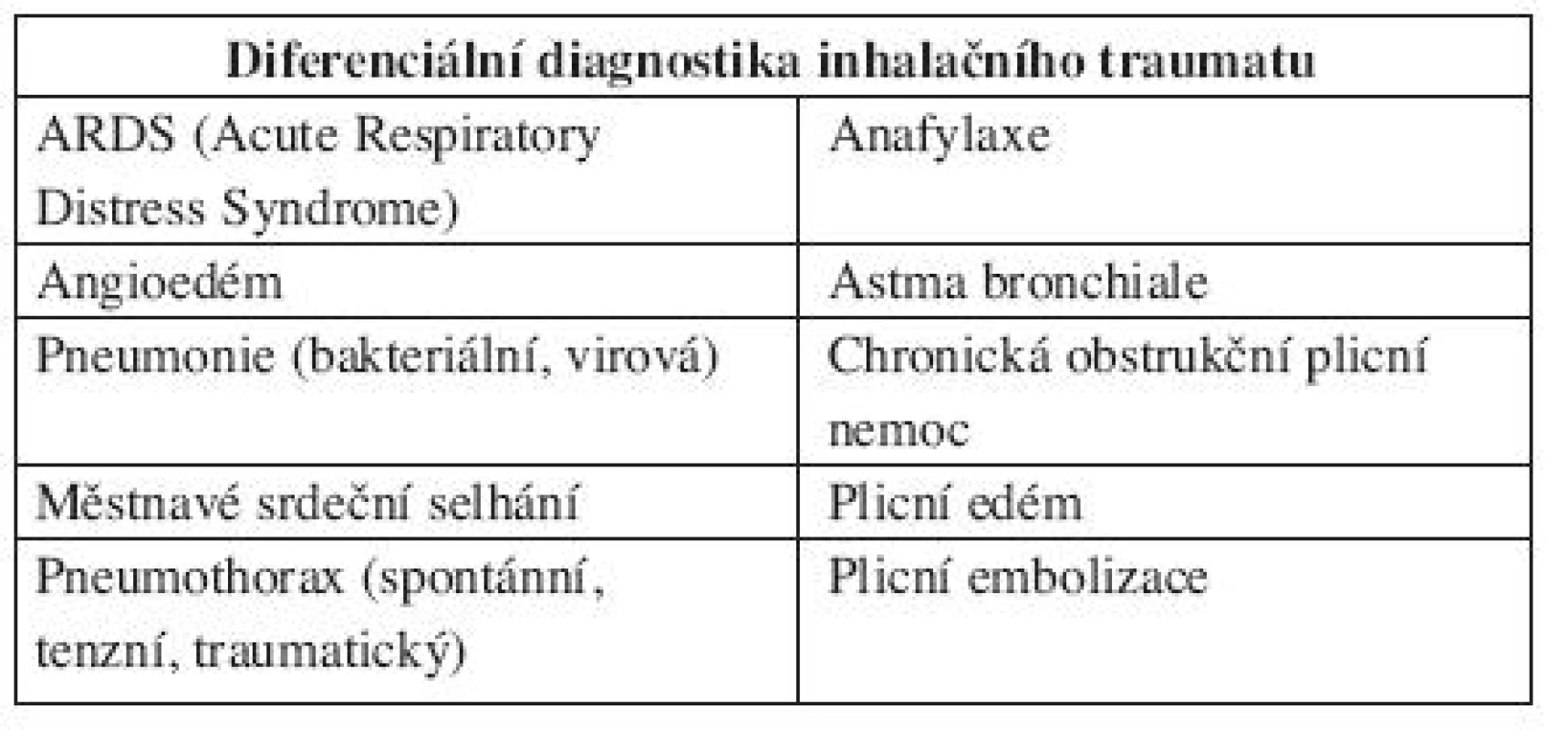
Samotná diagnóza inhalačního traumatu není ve většině případů složitá. Pro diagnostiku inhalačního traumatu je celosvětově nejrozšířenější použití flexibilního bronchoskopu, ev. doplněnou následným cytologickým a biochemickým vyšetřením materiálu získaného z bronchoalveolární laváže (20). Velkou výpovědní hodnotu má také přímá laryngoskopie, ovšem použití pouze této metody nelze doporučit. V řadě studií byla zjištěna výrazná korelace mezi klinickým obrazem a bronchoskopickým vyšetřením v diagnostice inhalačního traumatu. Navíc byly vypracovány metody gradingu inhalačního traumatu, které se opírají o kombinaci bronchoskopie s dalšími klinickými a zobrazovacími metodami (PaO2/FiO2, RTG srdce a plic). Diagnostika inhalačního traumatu se vždy opírá o komplexní přístup, který je znázorněn v tabulce 5 (12, 18). Stavy, které mohou imitovat inhalační trauma, a které je nutno v rámci diferenciální diagnostiky odlišit, jsou zobrazeny v tabulce 6.
Pacienti s inhalačním traumatem jsou pochopitelně ohroženi narůstajícím otokem dýchacích cest vrcholícím 24-36 hodin po inzultu, proto je nutnost intubace a zahájení umělé plicní ventilace. Při pokročilém edému může být pacient již obtížně zaintubovatelný, proto řada lékařů preferuje „profylaktickou“ intubaci u každého pacienta s podezřením na inhalační trauma. Základní důvody pro intubaci pacientů s inhalačním traumatem jsou znázorněny v tabulce 7.

Terapie
Základním předpokladem k úspěšné terapii inhalačního traumatu je zajištění dýchacích cest a vhodně volená indikace k orotracheální intubaci. Dále je léčba inhalačního traumatu kombinací podpůrné terapie, antiedematózní terapie (20). Inhalační trauma zvyšuje nároky na objemovou resuscitaci v prevenci hypoperfúze tkání a pro určité inhalované toxiny je specifický přístup k léčbě (kyanovodík, CO), jež bude popsán v samostatném oddílu.
V zajištění dýchacích cest se uplatňuje nejen orotracheální intubace, ale také tracheostomie. Mezi nesporné výhody tracheostomie v porovnání s orotracheální intubací patří snížení mrtvého prostoru, zlepšení toalety dýchacích cest, snížení sedace, možnost orálního příjmu potravy, lepší mobilizace pacienta a bezpečnější weaning (17). Ovšem jedná se o invazivní výkon s komplikacemi časnými jako krvácení, malpozice apod., a pozdními jako tracheoezofageální píštěl, obstrukce nebo estetické komplikace v následně formované jizvě.
Umělá plicní ventilace je indikována v případě, když jsou přítomny nebo nastupují známky respiračního selhání. Ventilačně-oxygenační parametry, varující před hrozícím nástupem respiračního selhání, jsou zejména: PaO2<65 mmHg, PaCO2> 50 mmHg, PaO2/PaCO2<200 nebo tachypnoe >30 dechů/min. Stále neexistuje univerzální doporučení na optimální ventilační režim. Ovšem všeobecného konsenzu v tomto bodě nebude pravděpodobně nikdy dosaženo, protože základním požadavkem na režim umělé plicní ventilace je nutnost individualizace směrem k pacientovi a ne směrem k mechanismu úrazu. Nejdůležitější změny v jednotlivých parametrech umělé plicní ventilace během posledních třech dekád jsou zaznamenány v tabulce 8. Zásadní význam pro zlepšení šancí na přežití pacientů s inhalačním traumatem mělo masovější rozšíření mechanické ventilace pozitivním přetlakem v dýchacích cestách v průběhu 60. a 70. let minulého století. Další rozvoj mechanické ventilace umožnil individualizaci ventilačního režimu dle potřeb pacienta. Výsledkem tohoto trendu byl stále častější posun od konvenčních ventilačních režimů jako PC (pressure control), VC (volume control) a PRVC (pressure related volume control) k relativně novějším ventilačním režimům jako HFPV (high-frequency percussive ventilation) nebo APRV (airway pressure release ventilation) (6, 26, 27). Vysokofrekvenční ventilátory nesplnily všechny naděje do nich vkládané. APRV jako časově cyklovaný, tlakově kontrolovaný režim umělé plicní ventilace, který umožňuje spontánní dýchání během ventilačního cyklu, se v současné době jeví jako nejbezpečnější režim v prevenci VILI (ventilator induced lung injury) u pacientů s inhalačním traumatem.

ECMO (extrakorporální membránová oxygenace) je používaná u pacientů se závažným respiračním selháním. U pacientů s inhalačním traumatem je používaná zcela raritně, protože indikací nebývá ve většině případů inhalační trauma, ale spíše postižení plic z důvodu agresivní ventilace, barotraumatu nebo toxicity kyslíku (34).
Kortikosteroidy
V současné době v terapii inhalačního traumatu nejsou doporučovány, vzhledem k tomu, že použití kortikosteroidů ve velkých studiích nepotvrdilo jejich benefit. Dříve se používal inhalačně zejména Beclomethason. Navíc vzhledem k jejich imunosupresivnímu účinku se významně zvyšuje šance na rozvoj infekčních komplikací dolních dýchacích cest (tracheobronchitidy, pneumonie). Přesto se kortikosteroidy používají v terapii neinfekčních pozdních komplikací inhalačního traumatu (alveolitis, ARDS) (36).
Antibiotika
Profylaktické podávání antibiotik u pacientů s inhalačním traumatem je dnes velmi kontroverzní. Obecně se ovšem použití antibiotik v profylaktickém podávání nedoporučuje. Otázkou ovšem zůstává, jestli podávání antibiotik u pacientů s inhalačním traumatem není spíše pre-emptivní, nežli profylaktické. Jednoznačně se doporučuje cílené podávání antibiotik jako výsledek mikrobiologické surveillance dolních dýchacích cest. U pacientů s inhalačním traumatem může pouze včasná a agresivní terapie tracheobronchitidy odvrátit rozvoj pneumonie se všemi jejími důsledky (9, 31).
Bronchodilatancia
V rámci inhalační terapie, mají ß2-sympatomimetika bronchodilatační a částečně protizánětlivý efekt, zlepšují mukociliární funkci, redukují kapilární leak, snižují množství uvolňovaného histaminu a inhibují fosfolipázu A2. Způsobují tachykardii a hypokalemii. Jejich terapeutický přínos je zejména u postižení dolních dýchacích cest, kdy rozvinutá chemická tracheobronchitida obvykle provokuje bronchospasmus. Řada experimentálních studií potvrzuje příznivý efekt ß2-sympatomimetik, ovšem velká klinická studie stále chybí. Při nedostatečném efektu ß2-sympatomimetik a přetrvávajícím bronchospasmu lze podat nebulizací adrenalin v dávce 0,25-0,5 ml (naředěný v 3ml 0,9% NaCl) každých 6 hodin (17).
Látky ovlivňující oxidační stress, kapilární permeabilitu
Kombinace nefrakcionovaného heparinu (UHF) s N-acetylcysteinem v inhalačním podání potencuje vzájemný efekt obou látek v mukolytické funkci a navíc fungují jako scavangery volných kyslíkových radikálů. Inhalačně se podává 5.000-10.000 IU UHF a 3-5ml 10% N-acetylcysteinu každé 4 hodiny.
Dále do skupiny preparátů, příznivě ovlivňující oxidační stres a eliminaci volných kyslíkových radikálů, patří vitamin E, deferoxaminu (pentaškrobový komplex) či dimethyl-sulfoxid.
Naopak velké naděje se vkládaly do allopurinolu, který se v praxi neosvědčil (4, 8, 22).
Oxid uhelnatý
Ve Spojených státech amerických je každý rok přijato okolo 15 000 pacientů s diagnózou otravy oxidem uhelnatým a zhruba 500 pacientů na tuto diagnózu každoročně zemře (17).
Oxid uhelnatý je bezbarvý plyn bez zápachu, produkovaný při nedokonalém hoření. Jeho afinita k hemoglobinu je 200-250x vyšší než vazba kyslíku na hemoglobin. Jedná se o kompetitivní navázání oxidu uhelnatého na hemoglobin, což znemožňuje vazbu, transfer a uvolnění kyslíku z hemoglobinu (15). Navíc dochází k vazbě oxidu uhelnatého a kompetitivní inhibici funkce intracelulárních cytochromů. Tím dále dochází k neschopnosti uklizovat kyslík také intracelulárně, a tedy celý deficit se ještě dále prohlubuje.
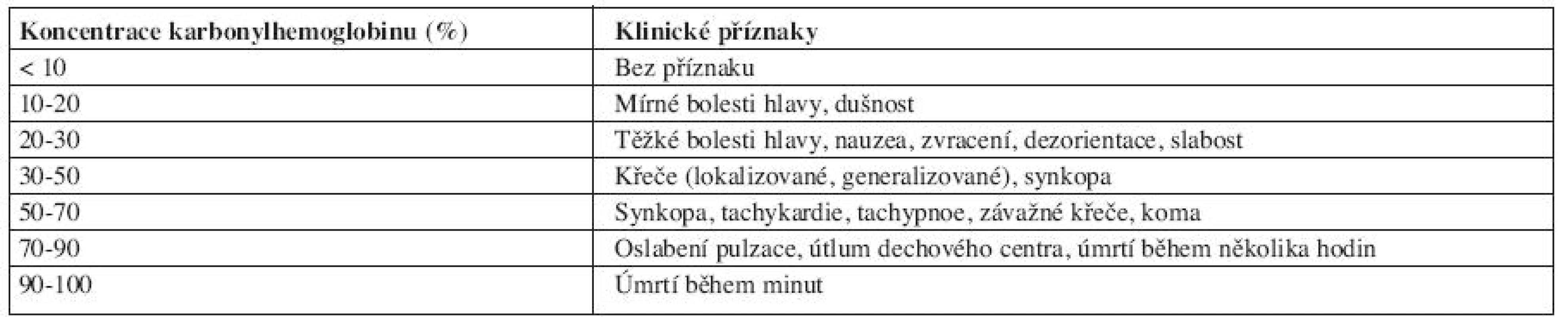
Symptomatika otravy oxidem uhelnatým je úzce spojena s koncentraci karbonylhemoglobinu (COHb) v krvi. Jednotlivé klinické příznaky v závislosti na COHb jsou znázorněny v tabulce 9.
Diagnostika otravy oxidem uhelnatým vychází z kombinace anamnézy (výbuch, hoření v uzavřené místnosti, informace o materiálu, který hořel) a dále vyšetřením arteriálních krevních plynů a koncentrace karbonylhemoglobinu (COHb). Při koncentracích nad 10-15 % je vždy nutno pacienta zaintubovat a zahájit umělou plicní ventilaci se 100% frakcí inspirovaného kyslíku FiO2. Při koncentracích nad 25-30 % je indikována hyperbarická oxygenoterapie. U člověka je biologický poločas COHb při 21% FiO2 a tlaku 1 atmosféry 320 minut, při 100% FiO2 a tlaku 1 atmosféry 60 minut a při 100% FiO2 a tlaku 3 atmosfér pouze 23 minut. Pouze včasná a správně indikovaná hyperbarická oxygenoterapie může odvrátit hrozbu neurologického deficitu (17).
Prognóza pacientů je závislá na koncentraci COHb a rychlosti s jakou je poskytnuta adekvátní terapie. Jednoznačně nepříznivé jsou prognózy u pacientů, u kterých je vstupní hladina COHb nad 50 %.
Kyanovodík
Jedná se o bezbarvý plyn se zápachem po hořkých mandlích. Používá se proti hmyzu a hlodavcům. Vzniká při hoření plastů, polyuretanu, vlny nebo hedvábí. Kyanovodík je toxický pro mnoho enzymů v organismu. Váže se na enzymy s metalickou komponentou. Toxicita kyanovodíku je způsobena inhibicí buněčné oxygenace vazbou na Fe3+ cytochrom c oxidázy mitochondrií, která způsobuje jeho reverzibilní blokádu. Po inhalaci následuje velmi rychlá absorpce. U lidí je biologický poločas kyanidu 1-3 hodiny (1, 17, 19).
Diagnostika otravy kyanovodíkem je daleko složitější než u oxidu uhelnatého. Stanovení hladiny kyanidů v krvi je složité a časově náročné, nehodí se tedy pro akutní řešení situace. V diagnostice hrají opět roli informace o hořícím materiálu, ev. délce expozice a další víceméně nespecifické ukazatele. U pacientů bývá zaznamenána zvýšená laktatémie, spolu se zvýšením anion gapu. Pravidlem bývá metabolická acidóza. Typickým pro intoxikaci kyanovodíkem bývá zvýšení saturace O2 smíšené venózní krve. Dochází k fenoménu, který je v literatuře pojmenován jako arterializace venózní krve. Někdy může docházet k elevacím S-T úseků na EKG, a tedy k imitací akutního infarktu myokardu. Klinická manifestace intoxikace kyanidem závisí na koncentraci kyanovodíku v prostředí (tab. 10).
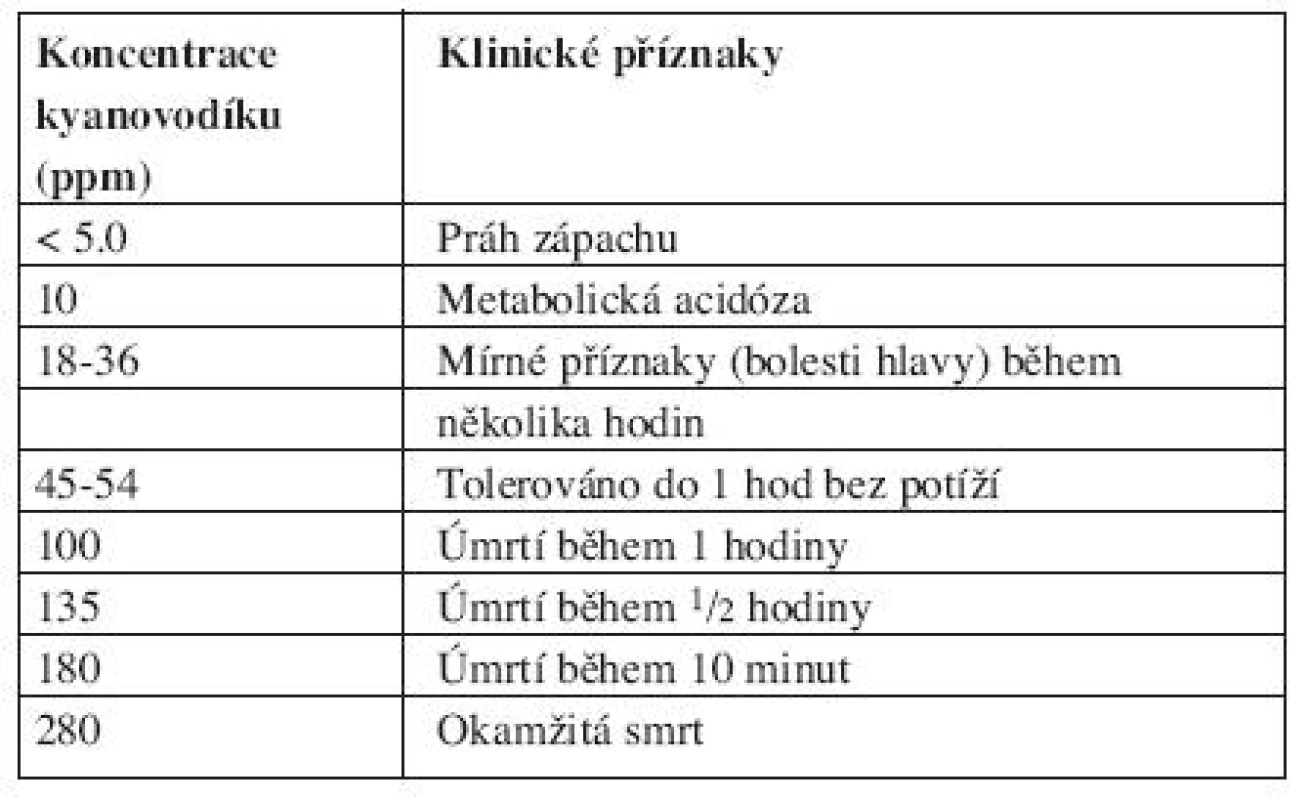
V terapii se opět uplatňuje urgentní odstranění postiženého z uzavřeného prostoru, intubace, nebo inhalace 100% kyslíkem, který může zrušit vazbu kyanidu na cytochromoxidázu. V laické první pomoci lze inhalačně podat amylium nitrosum (Amylnitrit), který způsobí zvýšenou methemoglobinemii (až 5%). V lékařské první pomoci se již podává specifické antidotum natrium tiosulfát (4-12 g i.v.), který je donorem síry. Díky tomu dojde ke konverzi toxického kyanovodíku na netoxický tiokyanát jaterním enzymovým systémem (rodonázou).
Ve Spojených státech amerických se v terapii intoxikace kyanovodíkem používá tzv. Pasadena-kit, který obsahuje amylnitrit, thiosulfát a sodium nitrit. Vzhledem k tomu, že tato směs generuje významné množství methemoglobinu (větší než monoterapie amylnitritem), nedoporučuje se podání této směsi v přednemocniční fázi (3).
Naopak hydroxykobalamin (70 mg/kg i.v.) se dle posledních klinických studií zdá být efektivní a bezpečný i pro použití v přednemocniční fázi léčby (16).
Pozdní komplikace
Pozdní komplikace inhalačního traumatu se mohou rozdělit podle lokalizace na komplikace v oblasti průdušnice (trachey) a v aborálnější části dolních dýchacích cest. Tracheální komplikace jsou z tohoto pohledu častější a zahrnují zejména tracheitidu, tracheální ulcerace, tracheoezofageální píštěle nebo tvorbu granulomů. Preferenční oblast pro tvorbu stenózy je v oblasti subglotického prostoru – fixace manžety orotracheální nebo tracheostomické kanyly. Tíže tracheální stenózy je velmi variabilní od asymptomatického až po těžkou obstrukci dolních dýchacích cest vyžadující korekční operaci (22, 36).
Další komplikace v oblasti dolních dýchacích cest jsou relativně vzácné. Základním diagnostickým přístupem jsou zobrazovací metody (HRCT, bronchoskopie) a funkční plicní testy – spirometrie.
ZÁVĚR
Diagnostika a terapie inhalačního traumatu představují velkou výzvu pro lékaře a ošetřující personál. Pouze multioborový přístup může vést k zlepšení prognózy pacientů s tímto typem poranění.
Inhalační trauma je stále pojmem spíše kvalitativním, exaktní stratifikace závažnosti postižení je dnes stále obtížná. Proto do budoucna bude hlavním cílem implikace jednoduchých biochemických nebo imunologických markerů tíže postižení a stanovení tak pevného gradingu inhalačního traumatu. Další, významnější kapitolou, bude zdokonalení protokolů mikrobiologického monitoringu situace v dolních dýchacích cestách, zlepšení a urychlení diagnostiky infekčních komplikací v terénu inhalačního traumatu.
Jako u jiných typů úrazu je lepší inhalačnímu traumatu předejít, nežli-ho léčit. Prevence u cílové skupiny je a bude velmi problematická, protože velké množství pacientů s inhalačním traumatem generují výbuchy načerno postavených palíren alkoholu nebo varen drog.
MUDr. Břetislav
Lipový
Klinika
popálenin a rekonstrukční chirurgie FN
Jihlavská
20
625
00 Brno
e-mail:
b.lipovy@seznam.cz
Zdroje
1. Alcorta, R.: Smoke inhalation and acute cyanide poisoning.: Hydrogen cyanide poisoning proves increasingly common in smoke-inhalation victims. JEMS, 29, 2004, 8, Suppl., s. 6-15.
2. Bidani, A.; Wang, C. Z.; Heming, T. A.: Early effects of smoke inhalation on alveolar macrophage functions. Burns, 22, 1996, s. 101-106.
3. Borron, S. W.: Recognition and treatment of acute cyanide poisoning. J. Emerg. Nurs., 32 (4 Suppl.), 2006, s. 12-18.
4. Brown, M., Desai, M., Traber, L. D., Herndon, D. N., Traber, D. L.: Dimethylsulfoxide with heparin in the treatment of smoke inhalation injury. J. Burn. Care Rehabil., 9, 1988, 1, s. 22-25.
5. Cocoanut Grove fire. Dostupný z WWW:<http://en.wikipedia.org/wiki/Cocoanut_Grove _fire>.
6. Dart, B., Maxwell, R., Richard, C., Brooks, D., Ciraulo, D., Barker, D., Burns, R. P.: Preliminary experience with airway pressure release ventilation in a trauma/surgical intensive care unit. J. Trauma, 59, 2005, s. 71-76.
7. De la Cal, M. A., Cerdá, E., García-Hierro, P. et al.: Pneumonia in patients with severe burns: A classification according to the concept of the carrier state. Chest, 119, 2001, s. 1160-1165.
8. Desai, M. H., Mlcak, R., Richardson, J., Nichols, R., Herndon, D. N.: Reduction in mortality in pediatric patients with inhalation injury with aerosolized heparin/N-acetylcystine [correction of acetylcystine] therapy. J. Burn. Care Rehabil., 19, 1998, 3, s. 210-212.
9. Desai, M. H., Rutan, R. L., Herndon, D. N.: Managing smoke inhalation injuries. Postgrad. Med., 86, 1989, s. 69-76.
10. Drost, A. C., Burleson, D. G., Cioffi, W. G. Jr, Mason, A. D. Jr, Pruitt, B. A. Jr.: Plasma cytokines after thermal injury and their relationship to infection. Ann. Surg., 218, 1993, s.74-78.
11. Einhorn, I. N.: Physiological and toxicological aspects of smoke produced during the combustion of polymeric materials. Environ Health Perspect, 11, 1975, s. 163-189.
12. Endorf, F. W., Gamelli, R. L.: Inhalation injury, pulmonary perturbations, and fluid resuscitation. J. Burn. Care Res., 28, 2007, s. 80-83.
13. Enkhbaatar, P., Traber, D.: Pathophysiology of acute lung injury in combined burn and smoke inhalation injury. Clin Sci (Lond.), 107, 2004, 2, s. 137-143.
14. Finnerty, C. C., Herndon, D. N., Jeschke, M. G.: Inhalation injury in severely burned children does not augment the systemic inflammatory response. Crit. Care, 11, 2007, 1, R22.
15. Goldbaum, L. R., Orellano, T., Serval, E.: Mechanism of the toxic action of carbon monoxide. Ann. Clin. Lab. Sci., 6, 1976, s. 372-376.
16. Guidotti, T.: Acute cyanide poisoning in prehospital care: new challenges, new tools, for intervention. Prehosp. Disaster Med., 21, 2005, 2, s. 40-48.
17. Herndon, D. N.: Total burn care. Philadelphia, Saunders ELSEVIER, 2007, s. 248-261.
18. Chou, S. H., Lin, S. D., Chuang, H. Y. et al.: Fiber-optic bronchoscopic classification of inhalation injury: Prediction of acute lung injury. Surg.Endosc., 18, 2004, s. 1377-1379.
19. Jones, J., McMullen, M. J., Dougherty, J.: Toxic smoke inhalation: cyanide poisoning in fire victims. Am. J. Emerg. Med., 5, 1987, 4, s. 317-321.
20. Kaloudová, Y., Brychta, P., Řihová H., Suchánek, I., Hrubá, J., Seidlová, D., Hrazdírová, A., Kubálek, V.: Inhalation injury. Acta Chir. Plast., 4, 2000, s. 115-117.
21. Lafferty, K. A., Ghett, H. J.: Smoke inhalation. Emedicine, 2010. Dostupný z WWW: <http://emedicine.medscape.com/article/771194-overview>.
22. Mlcak, R. P., Suman, O. E., Herndon, D. N.: Respiratory management of inhalation injury. Burns, 33, 2007, s. 2-13.
23. Murakami, K., Traber, D. L.: Pathophysiological basis of smoke inhalation injury. News Physiol. Sci., 18, 2003, s. 125-129.
24. Pittman, H. S., Schatzki, R.: Pulmonary effects of the cocoanut grove fire — A five-year follow-up study. N. Engl. J. Med, 241, 1949, s. 1008-1009.
25. Rajpura, A.: The epidemiology of burns and smoke inhalation in secondary care: a population-based study covering Lancashire and South Cumbria. Burns, 28, 2002, s. 121-130.
26. Reper, P., Van Bos, R., Van Loey, K., Van Laeke, P., Vanderkelen, A.: High frequency percussive ventilation in burn patients: hemodynamics and gas exchange. Burns, 29, 2003, 6, s. 603-608.
27. Reper, P, Wibaux, O., Van Laeke, P., Vandeenen, D., Duinslaeger, L., Vanderkelen, A.: High frequency percussive ventilation and conventional ventilation after smoke inhalation: a randomized study. Burns, 28, 2002, 5, s. 503-508.
28. Rue, L. W. III., Cioffi, W. G., Mason, A. D. Jr. et al.: The risk of pneumonia in thermally injured patients requiring ventilatory support. J. Burn Care Rehabil., 16, 1995, 3, s. 262-268.
29. Saffle, J. R.: The 1942 fire at Boston‘s cocoanut grove nightclub. Am. J. Surg., 166, 6, 1993, 6, s. 581-591.
30. Saffle, J. R., Davis, B., Williams, P.: Recent outcomes in the treatment of burn injury in the United States: a report from the American Burn Association Patient Registry. J. Burn Care Rehabil., 16, 1995, 3, s. 219-289.
31. Sheridan, R. L.: Airway management and respiratory care of the burn patient. Int Anesthesiol Clin., 38, 2000, 3, s. 129-145.
32. Schulte, J. H.: Effects of mild carbon monoxide intoxication. Arch. Environ Health, 7, 1963, s. 524-530.
33. Still, J., Friedman, B., Law, E. et al.: Burns due to exposure to steam. Burns, 27, 2001, s. 379.
34. Thomson, J. T, Molnar, J. A., Hines, M. H. et al.: Successful management of adult smoke inhalation with extracorporeal membrane oxygenation. J. Burn Care Rehabil., 26, 2005, s. 62-66.
35. Traber, D. L., Schla, G., Redl, H., Traber, L. D.: Pulmonary edema and compliance changes following smoke inhalation. J. Bum Care Rehab., 6, 1985, s. 490-494.
36. Valová, M., Königová, R., Brož, L., Vajtr, D.: Early and late complications of inhalation injury. Annals of Burns and Fire Disasters, 17, 2004, 1, s. 16-20.
37. Weiss, S. M., Lakshminarayan, S.: Acute inhalation injury. Clin. Chest Med., 15, 1994, 1, s. 103-116.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie OtorinolaryngologieČlánek vyšel v časopise
Otorinolaryngologie a foniatrie

2011 Číslo 1
Nejčtenější v tomto čísle
- Inhalační trauma – historie, současnost a budoucnost
- Výskyt komplikácií po rekonštrukcii blany bubienka
- Laryngotracheoezofageální rozštěp
- Perkutánna endoskopická gastrostómia v liečbe pacientov s pokročilými nádormi hlavy a krku
