Atypická koincidence hereditárního angioedému, systémového lupus erythematodes a karcinomu jazyka
Unusual Coincidence of the Hereditary Angioedema, Systemic Lupus Erythematodes and Tongue Carcinoma
Hereditary angioedema (HEA) caused by C1 esterase inhibitor deficiency is a rare autosomal dominant inherited disorder. It is characterized by recurrent episodes of potentially life-threatening swellings without itching localized in the dermis and submucosa. The most dangerous is laryngeal edema. We report a case of the young woman in whom the correct diagnosis of HEA was delayed 11 years. Hereditary angioedema in this patient was presented not only as episodes of localized head and extremities skin swellings but also as painful gastrointestinal attacks. She revealed several severe nasopharyngeal and laryngeal attacks. Systemic lupus erythematodes and tongue carcinoma as independent complications were evolved in time. This report underlines the fact that hereditary angioedema is often neglected in differential diagnoses. If hereditary angioedema is diagnosed, effective treatment which might be life-saving and highly improving patients’ quality of life is available. .
Key words:
angioedema, C1 inhibitor, icatibant, danazol, lupus, tongue carcinoma.
Autoři:
P. Králíčková; E. Burešová; J. Krejsek; I. Krčmová
Působiště autorů:
Ústav klinické imunologie a alergologie LF UK a FN, Hradec Králové, přednosta prof. RNDr. J. Krejsek, CSc.
Vyšlo v časopise:
Otorinolaryngol Foniatr, 60, 2011, No. 3, pp. 163-168.
Kategorie:
Kazuistiky
Souhrn
Hereditární angioedém (HEA) je autozomálně dominantně dědičné onemocnění, které je zapříčiněno deficiencí inhibitoru C1 esterázy. Je charakterizováno opakujícími se atakami potenciálně život ohrožujících nesvědivých otoků v dermis a submukóze. K nejzávažnějším důsledkům vede otok v oblasti hrtanu. Popsaný případ mladé ženy, jejíž diagnóza byla stanovena po 11 letech od prvních příznaků onemocnění, ukazuje na naléhavost celé problematiky. Trpěla nejen otoky v oblasti kůže hlavy a končetin, ale také zažívacího traktu a v neposlední řadě prodělala i několik závažných atak postihujících měkké tkáně nasofaryngu a hrtanu. Později onemocněla i systémovým lupusem a karcinomem jazyka (zcela náhodná koincidence nesouvisející s mutací genu pro inhibitor C1 esterázy). Případ dokazuje, že toto onemocnění bývá často v diferenciálně diagnostické rozvaze opomíjeno. Přitom je jeho diagnostika klíčová pro účinný terapeutický zásah, který může být i život zachraňující a jednoznačně zvyšuje kvalitu života nemocných.
Klíčová slova:
angioedém, C1 inhibitor, icatibant, danazol, lupus, karcinom jazyka.
ÚVOD
Hereditární angioedém je autozomální dominantně dědičné onemocnění, pro které je charakteristická tvorba nebolestivých, nesvědivých otoků podkoží a sliznic. Příčinou je genová mutace, která způsobuje absolutní či relativní nedostatek (tvorba afunkčního proteinu) C1 inhibitoru. V populaci se vyskytuje s frekvencí 1:50 000 až 1: 150 000 bez závislosti na rase či pohlaví (13, 17).
C1 inhibitor je multifunkční inhibitor serinových proteáz, které se vyskytují v plazmě. Je tvořen hepatocyty, aktivovanými makrofágy a dalšími buňkami. Je jediným známým inhibitorem aktivovaných proteáz klasické dráhy komplementu - C1r, C1s a serinových proteáz (MASP-1 a 2) aktivovaných lektinovou cestou. Dále významně inhibuje aktivovaný faktor XI, XII, kalikrein a trombin v koagulačním systému a tkáňový aktivátor plazminogenu (tPA) a plazmin ve fibrinolytickém systému (10).
Inhibicí přeměny prekalikreinu na kalikrein reguluje tvorbu bradykininu, který je u pacientů s hereditárním angioedémem zásadní pro vznik klinických příznaků u pacientů s hereditárním angioedémem. Deficit C1 inhibitoru vede k spontánní aktivaci C1 složky komplementu za současného spotřebovávání C2 a C4 složek komplementu. Výsledkem je produkce anafylaktických, chemotaktických a vazoaktivních mediátorů. Dochází ke zvýšení permeability cév a tvorbě otoků (13, 16, 17). Klinicky se HEA projevuje až při snížení aktivity C1 inhibitoru o více než 50 % (10).
KAZUISTIKA
22letá pacientka byla doporučena k vyšetření na náš ústav praktickou lékařkou pro recidivující otoky kůže a bolesti břicha nejasného původu.
V rodinné anamnéze se dozvídáme, že její matka trpívala po určitou dobu kožními otoky obdobného charakteru, nyní je však dlouhodobě bez obtíží.
Začátek obtíží naší nemocné se datuje do jejích 11 let ve formě křečovitých bolestí břicha provázených intenzivním zvracením a průjmy. Ataky trvaly asi po dobu 3 dní. V 15 letech podstoupila apendektomii. Opakovaně byla vyšetřována na gastroenterologii, vč. probatorní laparotomie (s normálním nálezem). Ataky se objevovaly s frekvencí jedenkráte za 3 měsíce, až jedenkrát měsíčně. Od 16 let se přidaly i rozsáhlé kožní otoky v oblasti končetin, obličeje a zad. Byly nesvědivé, bělavé a do 3 dní spontánně odeznívaly. Léčba antihistaminiky a kortikoidy byla zcela neúčinná. Nejčastěji vznikaly po předcházejícím mechanickém impulzu (pád či úder, pečení cukroví, sekání dříví, nesení těžké tašky s nákupem apod.). V 18 letech porodila zcela bez komplikací zdravou dceru. Od 20 let udávala intermitentní nesvědivou kožní vyrážku v oblasti obličeje a rukou, která se vždy výrazně horšila po oslunění. Kožní nález byl uzavírán jako solární dermatitida. Četněji trpívala na záněty vaječníků a močových cest. Další obtíže neudávala.
Na základě těchto klinických údajů bylo vysloveno podezření na možnost hereditárního angioedému. To bylo podpořeno i opakovaným zjištěním snížené hladiny C4 složky komplementu 0,10 g/l (norma 0,20-0,40) g/l a C1 inhibitoru 0,077 (norma 0,15-0,30) g/l. C1q, C2 a C5 složky komplementu byly v normě. Vysoce suspektní diagnóza hereditárního angiodému pak byla následně potvrzena genetickým vyšetřením s nálezem heterozygotní mutace p.W243G missence v exonu 5 (záměna tryptofanu glycinem na 243. pozici genu pro C1-inhibitor) – vyšetření provedeno v Genetické laboratoři, Centru kardiovaskulárni a transplantační chirurgie, Brno.
Pro atypický kožní nález bylo doplněno i vyšetření autoimunitních parametrů s nálezem slabé pozitivity ANA (antinukleárního faktoru) a pozitivity protilátek anti Ro52 a antiLa. Doplněná kožní biopsie vyslovila podezření na kožní vaskulitídu. Nebyla však naplněna diagnostická kritéria pro systémový lupus erythematodes. Pro úplnost bylo provedeno i alergologické vyšetření s negativitou kožních testů i specifického IgE na inhalační alergeny.
S přihlédnutím na četnost atak a přání nemocné bylo přistoupeno k dlouhodobé profylaxi. Protože se jednalo o ženu fertilního věku, byla zvolena léčba kyselinou tranexamovou v dávce 500 mg 3x denně. Ta však byla bez výraznějšího klinického efektu. Navíc se opakovaně přidaly i otoky sliznic ústní dutiny a měkkého patra s nutností hospitalizace na ORL klinice. Celkem dvakrát otok přesahoval i do oblasti laryngu a bylo nutno provést tracheostomii. Z těchto důvodů byla zaměněna kyselina tranexamová za danazol (v úvodní dávce 400 mg denně, s postupným snížením na nejmenší účinnou dávku 200 mg denně) s dobrým klinickým efektem provázeným snížením frekvence atak angioedémů, jak v oblasti orofaciálníi, tak i gastrointestinálního traktu. Laboratorně došlo prakticky k normalizaci hladiny C1-inhibitoru. Současně před veškerými invazivní výkony (především stomatologickými ošetřeními) byla preventivně zajištěna intenzivní krátkodobou profylaxí.V té době nebylo ještě možné pacientku preventivně zajistit podáním koncentrátu C1 inhibitoru, a proto byla navýšena dávka danazolu několik dní před výkonem a v průběhu výkonu pak opakovaně parenterálně podána kyselina tranexamová. S ohledem na plánovanou druhou graviditu byl přechodně danazol vysazen a opětovně nasazena kyselina tranexamová. V prvním trimestru těhotenství nemocná prodělala pouze několik nezávažných kožních otoků. Otoky v oblasti gastrointestinálního traktu či laryngu se neobjevily. Porod, opět preventivně zajištěný nitrožilním podáním kyseliny tranexamové, proběhl zcela bez komplikací a pacientka porodila zdravou dceru. V průběhu kojení došlo několikrát k atakám břišního charakteru a jedenkrát k otoku larygu. Z těchto důvodů se opětovně vrátila k medikaci danazolem. Ataky pak prakticky vymizely. Laboratorně se v té době přidala i pozitivita autoprotilátek U1-RNP a protilátek proti centromerám. Z indikace revmatologa byla nasazena antimalarika s částečným klinickým efektem na kožní změny.
Ve svých 30 letech začala nemocná pozorovat náhlé zvětšování rezistence v oblasti pravé hrany jazyka, bolestivé, které posléze omezovalo i příjem potravy. Provedená biopsie prokázala středně diferencovaný dlaždicobuněčný karcinom, T2 NX MO. Pro obavy operatéra z možných komplikací nebyla pravostranná hemiglossectomie doplněna disekcí krčních uzlin (dle UZ vyšetření bez jasného podezření na metatastatické postižení), ale adjuvantní chemoradioterapií.
V současné době je nemocné 37 let, je v péči onkologa (poléčebné sledování, 7 let bez známek progrese), revmatologa (vedená pod diagnózou systémového lupusu erythematodes bez známek aktivity a dlouhodobě léčena hydroxychlorochininem v dávce 200 mg denně) a v neposlední řadě i imunologa. Z hlediska hereditárního angioedému je léčena dlouhodobě profylakticky danazolem v dávce 200 mg/den, za pravidelných kontrol jaterních testů a UZ břicha. Léčba není provázena poruchou menstruačního cyklu ani virilizačními známkami. Na základě platné legislativy je nově vybavena v našem centru pro léčbu akutní ataky angioedému icatibantem s.c. k domácímu použití. Před veškerými plánovanými invazivními výkony (především stomatologickými zákroky, operacemi či endoskopickým vyšetřeními) je vždy za základě předchozího schválení revizním lékařem zajištěna podáním koncentrátu C1-inhibitoru v dávce 500-1000 IU dle charakteru plánovaného výkonu.
V současné době ji obtěžují zejména rozsáhlé otoky kožního charakteru, které ji omezují při výkonu povolání (dělnice, úklidová služba). Ataky v oblasti gastrointestinálního traktu nejsou četné. Otoky v oblasti laryngu se od podstoupené léčby pro karcinom jazyka nevyskytly. Lze jen spekulovat, zda radioterapie v oblasti hlavy a krku způsobila změny v podkoží, které nedovolují rozvoj angioedému, či jde o variabilní průběh vlastního onemocnění.
Byla snaha o genetické dovyšetření rodinných příslušníků. Matka pacientky vyšetření odmítla. U první z dcer nebyla příčinná mutace objevena a je i klinicky zdráva. U druhé, 8leté, je genetické vyšetření plánováno v současné době.
DISKUSE
Diferenciální diagnóza
Hereditární angioedém není diagnosticky jednoduchou jednotkou. Obecně je angioedém definován jako limitovaný, lokalizovaný otok. Lze ho nalézt až u 15 % obecné populace, častěji u žen než u mužů. Až v polovině případů je provázen urtikárií. V 38 % uzavíráme diagnózu jako idiopatický angioedém (tedy bez znalosti primární příčiny). Četně pak nacházíme alergický (IgE mediovaný angioedém), dále pak angioedém asociovaný s léky (kyselina acetylsalicylová, nesteroidní antirevmatika, antihypertenziva – ACE inhibitory, narkotika, hormonální antikoncepce), indukovaný fyzikálními podněty (např. chlad, teplo, vibrace), četně se vyskytující u autoimunitních thyreopatií či velmi vzácně jako angioedém asociovaný s cytokiny (Gleichův syndrom – horečka, eozinofílie, 10-20% úbytek hmotnosti, elevace IgM, zvýšení hladin IL-3, IL-5 a IL-6) (19).
Pro svůj charakter a klinický význam je vhodné se více zmínit o angioedému souvisejícím s medikací ACE inhibitory, která vede k inhibici degradace bradykininu. Postihuje 3,5-9,4 % takto léčených nemocných. Vzniká často až řadu měsíců po zahájení užívání. Otoky typicky postihují především jazyk a rty, i když gastrointestinální projevy také nejsou vyloučeny. Nejsou provázeny svěděním či urtikárií. Bohužel u malé časti nemocných přetrvávají obtíže i po přerušení léčby. Byly zaznamenány i po použití medikace blokátory ACE II receptorů (14).
Dále v diferenciální diagnostice musíme vždy myslet, kromě hereditárního angioedému, i na získaný angioedém typ 1, asociovaný s lymfoproliferativními onemocněními (na základě konsumpce C1 inhibitoru malignímu buňkami), či typ 2, asociovaný s neutralizačními autoprotilátkami proti C1 inhibitoru (např. při systémovém lupus erythematodes). Klinickými projevy se vůbec neliší od hereditární formy (není tedy provázen urtikariálními projevy, nesvědí) (4, 13, 19).
Laboratorní diagnostika: Rádi bychom na tomto místě zdůraznili důležitost screeningového vyšetření sérové hladiny C4 složky komplementu, jako levného a přitom velice spolehlivého markeru. Jeho normální hladiny prakticky vylučují možnost hereditárního angioedému. Podrobnější laboratorní diagnostiku shrnuje tabulka 1.
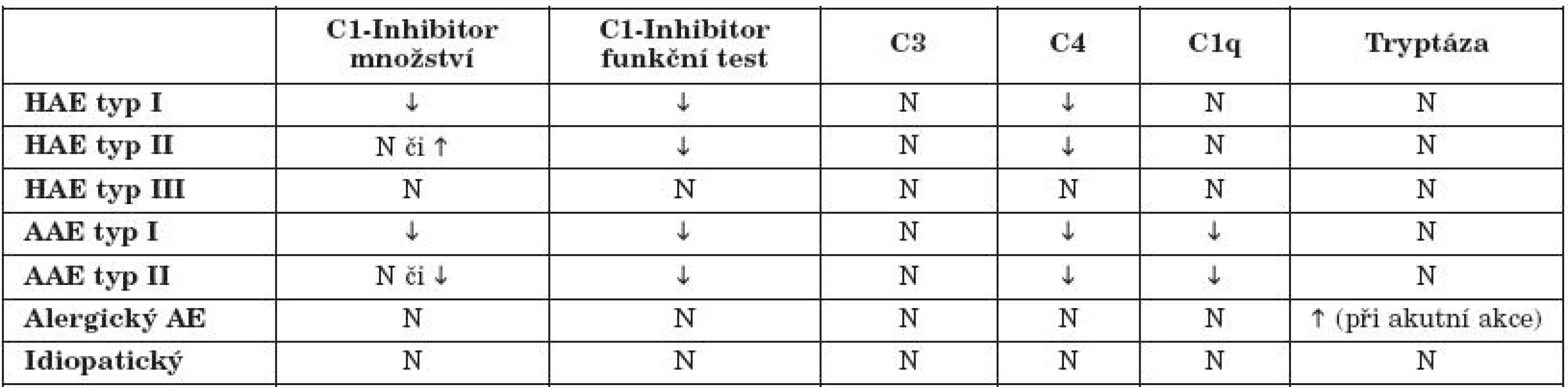
Klinická klasifikace hereditárního angioedému
- I. typ (85 % případů) nacházíme sníženou koncentraci C1 inhibitoru za současného snížení C4 složky komplementu.
- II. typ (15 % případů) normální či zvýšené hladiny C1 inhibitoru, který je dysfunkční.
- III. typ (velmi vzácně) – estrogen dependentní, s normálními hladinami C1 inhibitoru i C4 složky komplementu, kdy je na genetickém podkladě patologicky snížená aktivita koagulačního faktoru XII (4).
Klinický obraz
Ke klinické manifestaci onemocnění může dojít v jakémkoli věku, typicky pak ve druhé dekádě života. Spouštěcími mechanismy pro vznik otoků bývá lokální fyzikální působení (v praxi nejčetněji stomatologický výkon, endoskopické vyšetření, intubace, trauma), infekce, nelze pominout ani psychické vlivy (stres). Z farmak to pak bývá nasazení hormonální antikoncepce obsahující estrogeny či léčba ACE inhibitory. Otoky trvají obvykle déle než 12 hod., často 2-3 dny, a poté spontánně vymizí. Nejčastěji postihují podkoží v oblasti obličeje, končetin a genitálu. Jsou bělavého charakteru a nesvědí. Nemocní spíše popisují velmi nepříjemné pnutí až bolest. Nekonstantně můžeme zaznamenat v prodromálním stadiu i mimo něj kožní změny charakteru mapovitých obrazců na kůži, nazvané erythema marginatum. V oblasti gastrointestinálního traktu vedou k vyčerpávajícím, krutým, křečovitým bolestem, které bývají provázeny zvracením a vodnatými průjmy, vedoucím k významné hemokoncentraci s nebezpečím vzniku hypovolemického šoku. Pacienti s takovými projevy jsou četně vyšetřováni a operováni s podezřením na náhlou břišní příhodu. Na rozdíl od nich však kromě známek hemokoncentrace nenacházíme leukocytózu či vysoké CRP (C-reaktivní protein). Z klinických zkušeností vyplývá, že pacienti jsou sice prvních 72-96 hodin po atace refrakterní k dalšímu vzniku otoku, ale s větším odstupem jsou v důsledku invazivních vyšetřovacích metod vystavováni významnému riziku vyvolání dalšího záchvatu (18).
Nejvíce rizikový je vznik otoku v oblasti laryngu, uvuly, měkkého patra či jazyka, které mohou končit bez adekvátní pomoci úmrtím. Klinicky však může docházet k manifestaci v řadě dalších orgánů (CNS – s projevy bolestí hlavy a barvitými neurologickými nálezy, dále pak urogenitálního traktu, svalů, kloubů apod.). V průměru je zaznamenáván těžší průběh u žen a u pacientů s časnou manifestací (2, 13). Pro lékaře pečující o tyto nemocné je důležité si uvědomit, že i nemocní, kteří po mnoho let rozvíjejí pouze projevy kožní či gastrointestinální, jsou v doživotním riziku vzniku otoku i v oblasti laryngu.
Léčba
Po stanovení diagnózy je nezbytné s nemocnými navázat úzkou spolupráci. Opakovaně vysvětlit podstatu onemocnění, rizika a možnosti léčby. U dětí je vhodné pomoci při volbě zaměstnání a výběru volnočasových aktivit s vynecháním kontaktních sportů s rizikem traumatických příhod. Nelze opomenout i možnost vstoupit do pacientské organizace, která sdružuje v naší republice nemocné s hereditárním i získaným angioedémem. Je napojena na mezinárodní organizaci a je schopna svým členům poskytnout řadu cenných rad, včetně právní pomoci.
Léčbu je třeba členit na léčbu preventivní a léčbu akutních atak. Svá specifika má léčba angioedému v dětství a v průběhu gravidity, porodu či kojení.
Dlouhodobá profylaxe je indikována u klinicky závažných případů. Vždy je třeba zohlednit četnost a závažnost atak, postižený orgán, ale i přání pacienta ve smyslu jeho vnímání snížení kvality života, dnů pracovní neschopnosti či strachu ze závažných atak (8). Nezbytné je vyvinout maximální snahu o redukci spouštěčů atak (léčba infekčních fokusů, eradikace Helicobacter pylori, kontraindikace podání ACE inhibitorů a estrogenní hormonální léčby). V profylaxi je lékem první linie kyselina tranexamová. Inhibuje aktivaci plazminogenu, a tím snižuje počet a sílu atak. Její efektivnost je však poměrně nízká. Před dlouhodobým podáváním je vždy vhodné vyloučení trombofilních stavů. Jako nežádoucí účinek může působit nauzeu, závratě, průjem a stavy vyčerpání. Profylaktické dávkování dospělých činí 1g 3x denně (3, 5, 13).
Další lékovou skupinou používanou v dlouhodobé profylaxi jsou atenuované deriváty androgenů, v podmínkách České republiky (v rámci zvláštního léčebného programu) danazol, který zvyšuje syntézu C1- inhibitoru v játrech. Úvodní podávaná dávka je 400-600 mg/den, kterou se snažíme postupně snižovat na nejnižší účinnou dávku (např. 100 mg 3x týdně). Tato léková skupina však není vhodná pro děti, ženy ve fertilním věku či v průběhu těhotenství. Provází ji četné nežádoucí účinky (přírůstek hmotnosti, akné, hirzutismus, poruchy menstruačního cyklu, hypertenze, hepatopatie ve formě peliózy či adenomů, poruchy metabolismu lipidů s akcentací aterosklerózy a nelze opomenout ani zvýšení rizika trombembolismu či intrakraniální hypertenze apod.). Při používání obou skupin léků pravidelně kontrolujeme jaterní testy, lipidy a provádíme UZ jater. Kromě dlouhodobé profylaxe lze zvolit profylaxi nárazově před plánovaným rizikovým výkonem (stomatologické ošetření, endoskopické vyšetření, operace, porod), a to tranexamovou kyselinou v dávce 4 g/den u dospělého podanou ode dne -2 do dne +2, či častěji danazol 600 mg ode dne -5 do dne +3 po výkonu. V současné době se však dává jednoznačně přednost použití koncentrátu C1 inhibitoru 500-1000 j i.v. před výkonem (11).
Třetí formou je intermitentní profylaxe podávaná v rizikových obdobích života pacienta (infekce, menstruace, stres) (3, 5, 13).
Léčba akutních atak prodělala v posledním roce v naší zemi zásadní legislativní změny. Na prvním místě je třeba zdůraznit, že antihistaminika i kortikoidy jsou zcela neúčinné! Lékem první volby pro dospělé pacienty je v současné době icatibant (předpisem vázaný na centra). Icatibant je selektivní kompetitivní antagonista bradykininových receptorů typu 2 (B2). Je to syntetický dekapeptid, strukturálně velmi podobný bradykininu. Aplikuje se podkožně do oblasti břicha, přičemž jednotlivá dávka činí 30 mg účinné látky a počet podání je závislý na klinickém obrazu. K plné úlevě od příznaků dochází v průměru do 4 hodin od podání. Nově byl schválen i pro domácí použití samotným pacientem bez nutného dozoru zdravotnického personálu. Nežádoucí reakce se vyskytují nečetně až na poměrně frekventní nezávažné, lokální, samovolně odeznívající reakce v místě aplikace (1, 6, 12, 15).
Koncentrát C1 inhibitoru, do nedávné doby v naší republice používaný k prevenci i léčbě atak, je v současné době možno podat pouze v preventivní indikaci. K léčbě akutních atak je ho možné použít na základě platné legislativy pouze u dětských pacientů v dávce 7,5-14 j/kg dle závažnosti ataky, dávku dle efektu pak opakujeme (obvykle přehodnocujeme po 2 hodinách po podání). Ke zlepšení příznaků dochází do 30-60 minut. Příznaky zcela mizí do 24 hodin (1, 9, 11, 15). V případě podezření na náhlou břišní příhodu u pacienta s prokázanou diagnózou hereditárního angioedému je doporučováno v první řadě podání léku pro léčbu akutní ataky. Následovat by pak mělo vyšetření markerů zánětu a zobrazovací vyšetření (UZ břicha). Teprve v druhé době volit chirurgické řešení.
Další možnosti: Registračním řízením v naší republice prochází rekombinantní C1 inhibitor získávaný z mléka geneticky manipulovaných králíků. Je čištěný řadou technik zahrnujících chromatografii a nanofiltraci k odstranění virů. Ze 70 % se shoduje v amininokyselinových sekvencích s lidským C1 inhibitorem a prokazuje obdobnou účinnost při dobré toleranci a minimu nežádoucích účinků, i když nelze samozřejmě vyloučit možnost anafylaktické reakce (1).V USA byl schválen pro léčbu akutních atak ecallantide, rekombinantní protein produkovaný kvasinkami Pichia pastoris, který váže plazmatický kalikrein a ve svém důsledku inhibuje přeměnu HMW kininogenu na bradykinin (9). Slibné se zdá jeho uplatnění v případě získaného angioedému s přítomnými autoprotilátkami (10). Jsou však hledány i další cesty např. ve formě mutant C1 inhibitoru. Jedná se o „varianty“ serpinů, které mají funkční neutralizační kapacitu ve vztahu k proteázám, a proto jsou schopny šetřit zbytkově přítomný přirozený C1 inhibitor (1).
ZÁVĚR
Hereditární angioedém je dědičné, potenciálně život ohrožující onemocnění, které svými důsledky zasahuje do řady medicínských oborů. Kauzální léčba sice neexistuje, je však nezbytná včasná diagnostika, aby pacienti nebyli vystavováni nadměrnému riziku vyplývajícímu nejen z povahy vlastního onemocnění, ale i z řady prováděných vyšetřovacích a léčebných postupů. K dispozici jsou preparáty, které zabrání život ohrožujícím komplikacím a významně zlepší kvalitu života pacientů s hereditárním angioedémem.
MUDr. Pavlína
Králíčková
Ústav
klinické imunologie a alergologie LF UK a FN
Sokolská
581
500
05 Hradec Králové
e-mail:
kralickova.pavlina@fnhk.cz
Zdroje
1. Antoniu, S. A.: Therapeutic approaches in hereditary angioedema. Cloníc. Rev. Allerg. Immunol., 2011 (v tisku).
2. Bork, K.: Hereditary angioedema: New findings concerning symptome, affected organs, and course. Am. J. Med., roč. 119, 2006, č. 3, s. 267-274.
3. Bowen, T.: Management of hereditary angioedema: a Canadian approach. Transfus Apher Sci., roč. 29, 2003, č. 3, s. 205-214.
4. Cicardi, M.: Acqiured angioedema. Allergy Asthma Clin. Immunol., roč. 6, 2010, č. 14, s. 1-5.
5. Cicardi, M.: How do we treat patiens with hereditary angioedema. Transfus Apher Sci., roč. 29, 2003, č. 3, s. 221-227.
6. Cicardi, M.: Icatibant, a new bradkinin-receptor antagonist, in hereditary angioedema. N. Eng. J. Med., roč. 363, 2010, č. 6, s. 532-541.
7. Cichon, S.: Increased activity of coagulation factor XII (Hageman factor) cause hereditary angioedema type III. Am. J. Hum. Gen., roč. 79, 2006, č. 6, s. 1098-1104.
8. Craig, T.: When is prophylaxis for hereditary angioedema necessary? Ann. Allergy Astma Immunol., roč. 102, 2009, č. 5, s. 366-372.
9. Craig, T. J.: Efficacy of human C1 esterase inhibitor concentrate compared with placebo in acute hereditary angioedema attacks. J. Allergy Clin. Immunol., roč. 124, 2009, č. 4, s. 801-808.
10. Cugno, M.: C1-inhibitor deficienty and angioedema: molecular mechanisms and clinical progress. Tend. Mol. Med., roč. 15, 2009, č. 2, s. 69-78.
11. DeSerres, J.: Safety and efficacy of pasteurized C1 inhibitor concentrate (Berinet P) in hereditary angioedema: a review. Transfusion and Apheresis Sci., roč. 29, 2003, č. 3, s. 247-254.
12. Fincham, C. I.:. Bradykinin receptor antagonista – a review of the patent literature 2005-2008. Expert Opin. Ther. Pat., roč. 19, 2009, č. 7, s. 919-941.
13. Gompels, M. M.: C1 inhibitor deficiency: consensus document British Society for Immunology. Clin. Exp. Imunol., roč. 139, 2005, č. 3, s. 379-394.
14. Hoover, T.: Angiotensin converting enzyme inhibitor induced angio-oedema: a review o the pathophysiology and risk factors. Clin. Exp. Allegy, roč. 40, 2009, č. 1, s. 50-61.
15. Christiansen, S. C.: Update on therapeutic developments for hereditary angioedema. Allergy Astma Proc., roč. 30, 2009, č. 5, s. 500-505.
16. Krejsek, J.: Klinická imunologie. 1. vyd., Hradec Králové, Nucleus, 2004, 941 s., 80-86225-50-X.
17. Kuklínek, P.: Hereditární a získaný angioedém (deficit C1-INH). In: Špičák V. aj.: Alergologie. Praha, nakladatelství Galén, 2004, s. 257-262.
18. Rosen, F. S.: Deficiencies of C1 inhibitor. Best Pract. Res. Clin. Gastroenterol., roč. 19, 2005, č. 2, s. 251-261.
19. Temiňo, V. M.: The spectrum and treatment of angioedema. Am. J. Med., roč. 121, 2008, s. 282-286.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie OtorinolaryngologieČlánek vyšel v časopise
Otorinolaryngologie a foniatrie

2011 Číslo 3
Nejčtenější v tomto čísle
- Zkušenosti s lokální kortikoterapií při dysfunkcích Eustachovy tuby
- Idiopatická a zdanlivo idiopatická neuralgia nervus trigeminus
- Zriedkavá vrodená anomália krku: aneuryzma vena jugularis
- Polyganglionitída pri Bellovej obrne – klinická analýza
