Incidencia regionálnych okultných mikrometastáz pri karcinómoch hlavy a krku
Štefanička P., Valach M., Profant M.: The Incidence of Regional Occult Micrometastases in Squamous Cells Carcinoma Patients
Objectives:
The aim of the study was to determine incidence of occult micrometastases by semiserial sectioning and immunohistochemistry with cytokeratin in patients with head and neck squamous cell carcinoma with clinically negative neck.
Material and methods:
Eighteen patients with squamous cell carcinoma of the head and neck who primary underwent surgical treatment of the primary tumor and elective selective neck dissection were included in the study. Lymph nodes of neck dissection specimen were evaluated by semiserial sectioning at 200 μm interval with hematoxylin-eosin staining and immunohistochemical stain method using pan-cytokeratin AE1/3. Results: Of 18 patients, 28 neck dissections were harvested 600 lymph nodes. The incidence of occult micrometastases was 22.2% per patient, 14.3% per neck and 1% per lymph node. In 4 patients was pN upgrading from pN0 to pN+, 28.6%.
Conclusion:
The incidence of occult micrometastases in head and neck cancer patients detected by semiserial sectioning with cytokeratin immunohistochemistry is higher than conventional pathologic techniques. Use of this technique should more accurately identify patients for postoperative adjuvant treatment.
Key words:
occult metastases, micrometastases, isolated tumor cells, cytokeratin immunohistochemistry, head and neck squamous cell carcinoma.
Authors:
P. Štefanička 1; M. Valach 2; M. Profant 1
Authors‘ workplace:
I. ORL klinika LF UK, SZU, FNsP, Bratislava, prednosta prof. MUDr. M. Profant, CSc.
1; Alfa medical patológia, s. r. o., Bratislava, prednosta doc. MUDr. F. Ondriáš, CSc.
2
Published in:
Otorinolaryngol Foniatr, 60, 2011, No. 1, pp. 26-32.
Category:
Original Article
Overview
Cieľ:
Cieľom práce bolo zistiť incidenciu regionálnych okultných mikrometastáz semisériovým rezaním a imunohistochemickým vyšetrením na cytokeratíny u pacientov so skvamocelulárnym karcinómom hlavy a krku.
Materiál a metódy:
Lymfatické uzliny z krčného disekátu u 18 pacientov so skvamocelulárnym karcinómom hlavy a krku, ktorí absolvovali primárnu chirurgickú liečbu, boli semisériovo rezané v 200 μm intervaloch s farbením na hematoxylin-eosin a imunohistochemickým vyšetrením na dôkaz epitelových markerov (cytokeratínový koktail AE1/3).
Výsledky:
Z 18 pacientov, 28 krčných disekcií, sa získalo a vyšetrilo 600 lymfatických uzlín. Incidencia okultných mikrometastáz bola 22,2% na pacienta a 14,3% na stranu krku. Incidencia mikrometastáz na lymfatickú uzlinu bola 1%. K zmene z pN0 na pN+ došlo u štyroch pacientov, 28,6 %.
Záver:
Incidencia okultných mikrometastáz pri karcinómoch hlavy a krku detekovaná sériovými rezmi s doplneným imunohistochemickým vyšetrením na cytokeratíny je vyššia ako je diagnostikovaná rutínnym histopatologickým vyšetrením. Touto technikou by sa mohli presnejšie identifikovať pacienti na pooperačnú adjuvantnú liečbu.
Kľúčové slová:
okultné metastázy, mikrometastázy, izolované nádorové bunky, imunohistochemické vyšetrenie na cytokeratíny, karcinómy hlavy a krku.
ÚVOD
Metastázy do krčných lymfatických uzlín pri karcinómoch hlavy a krku sú považované za najvýznamnejší nepriaznivý prognostický faktor (12). Počet metastáz v lymfatických uzlinách, rozmer, lokalizácia na krku, prítomnosť makroskopického alebo mikroskopického extrakapsulárneho šírenia sú všetko dôležité faktory ovplyvňujúce prognózu pacienta (11, 29). Metastázy, ktoré neboli diagnostikované klinicky, ale iba následne histopatologickým vyšetrením, označujeme ako subklinické alebo okultné. Hoci okultné metastázy bývajú často mikrometastázy, termín okultných metastáz nie je synonymom. V súčasnosti rozlišujeme tri kategórie okultného metastatického postihnutia lymfatických uzlín: izolované nádorové bunky (INB), mikrometastázy (veľkosť do 2 mm) a makrometastázy (väčšie ako 2 mm) (12, 18, 26). Za štandardnú metódu na diagnostiku okultných metastáz sa stále považuje histopatologické vyšetrenie uzlín z krčného disekátu. Hoci pri klinicky (aj histopatologicky) pozitívnom uzlinovom náleze na krku ďalšie zistené mikrometastázy nehrajú takú dôležitú úlohu v posudzovaní štádia choroby, v prípade diagnostiky iba okultného metastatického postihnutia (mikrometastázy, INB) je uzlinový staging závislý na presnosti diagnostiky histopatológa. Čím je histopatologická metóda senzitívnejšia, tým je diagnostikovaný väčší počet mikrometastáz, eventuálne INB. Metastázy v lymfatických uzlinách sú rutínne vyšetrované jedným alebo dvomi pozdĺžnými rezmi cez lymfatickú uzlinu. Pričom jeden 10 μm rez predstavuje menej než 0,1 % objemu lymfatickej uzliny (8). Senzitivita vyšetrenia je znížená chybou množstva vyšetreného materiálu. Takto zostáva stále určité percento tzv. okultných mikrometastáz alebo subpatologických metastáz, ktoré boli prehliadnuté pri rutínnom histopatologickom vyšetrení. Sériové, alebo semisériové rezy, prípadne doplnené o imunohistochemické vyšetrenie s cytokeratínmi, zvyšujú diagnostickú presnosť, ale na druhej strane treba zhodnotiť pracnosť, časovú a finančnú náročnosť detailnejšieho histopatologického vyšetrenia v porovnaní s diagnostickým prínosom a prognostickým významom pre pacienta (1, 23).
V našej práci sme zisťovali incidenciu a lokalizáciu mikrometastáz semisériovými rezmi lymfatických uzlín krčného disekátu a imunohistochemickým vyšetrením na cytokeratíny u pacientov so skamocelulárnym karcinómom hlavy a krku a klinicky negatívnym uzlinovým nálezom na krku.
MATERIÁL A METÓDY
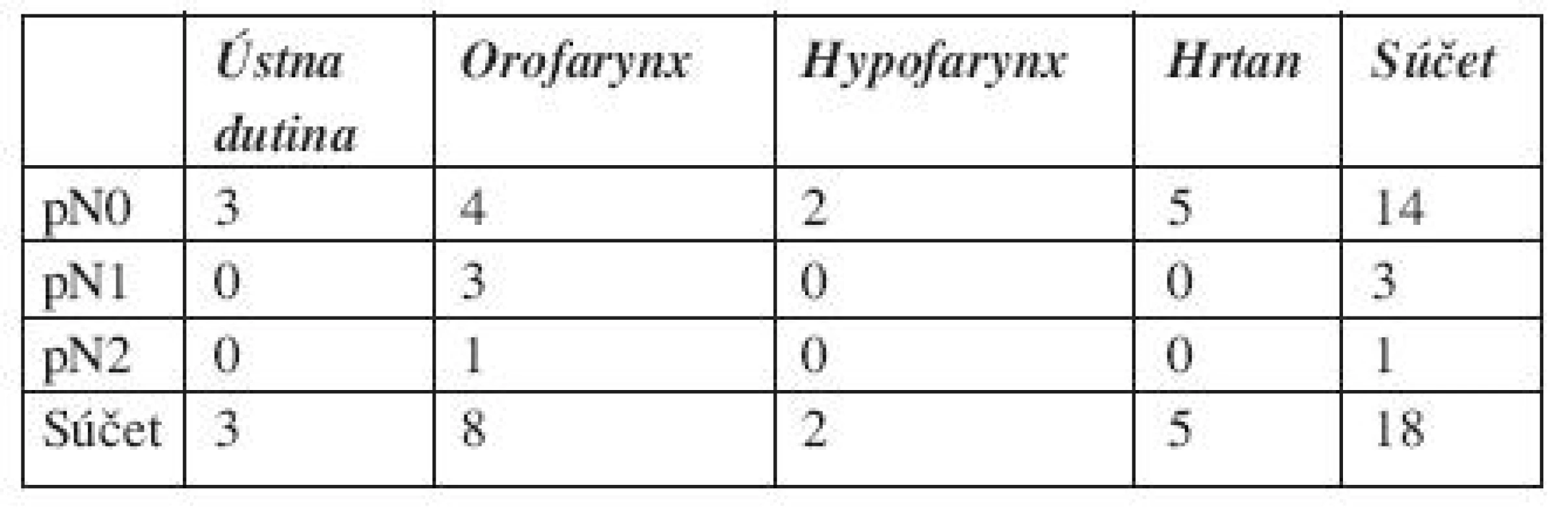
Do súboru bolo postupne zaradených 18 pacientov s histologicky verifikovaným skvamocelulárnym slizničným karcinómom hlavy a krku s klinicky negatívnym uzlinovým nálezom na krku. Všetci pacienti podstúpili elektívnu selek - tívnu krčnú disekciu ako primárnu chirurgickú liečbu krku. Priemerný vek pacientov bol 59,2 roka (48–73 rokov), 17 mužov, jedna žena. Súbor tvorilo 8 pacientov s karcinómom orofaryngu, 2 s karcinómom hypofaryngu, 5 pacientov s karcinómom hrtana a 3 pacienti s karcinómom ústnej dutiny. Z 28 krčných disekcií, 10 obojstranných, sme získali 600 lymfatických uzlín. Pacienti boli klasifikovaní podľa rutínneho histopatologického vyšetrenia, pN0 14 pacientov, pN1 traja pacienti a pN2c jeden pacient (tab. 1). Stupeň diferenciácie primárneho skvamocelulárneho karcinómu bol u piatich dobre diferencovaný G1, u jedného G1-2, u 11 pacientov stredne diferencovaný G2 a u jedného G2-3.
Po rutínnom histopatologickom vyšetrení sa materiál z krčného disekátu ďalej spracovával a každá jedna lymfatická uzlina sa dostala kompletne do parafínu. Lymfatické uzliny, ktoré nebolo možné spracovať do jedného bloku, sa rozrezali v rezoch kolmých na ich dlhú os, pričom sme z nich dostali viacero parafínových blokov v závislosti od veľkosti lymfatickej uzliny. Hoci maximálny rozmer uzliny v bloku môže byť asi do 10 mm, hrúbka spracovaného parafínového bloku, teda rovina, v ktorom sa budú vyhotovovať HE rezy, je do 2 mm. Mikrometastázy a izolované nádorové bunky sme klasifikovali podľa TNM klasifikácie zhubných nádorov (6. vydanie z roku 2002), v ktorej sa za mikrometastázu považuje nádorový depozit nepresahujúci 2 mm v najväčšom rozmere so znakmi implantácie, extravazácie a proliferácie nádorových buniek, alebo stromálnej reakcie. Izolované nádorové bunky sa tu definujú ako jednotlivé bunky nádoru, alebo malé zhluky buniek nie väčšie ako 0,2 mm v najväčšom rozmere, bez kontaktu s cievnou stenou alebo sinusom, bez extravazácie, proliferácie alebo stromálnej reakcie. Po zhotovení parafínových blokov sme urobili z každého jedného bloku 10 HE rezov a na každý tretí rez sme aplikovali imunohistochemické vyšetrenie na dôkaz epitelových markerov (cytokeratínový koktail AE1/3). Pri hrúbke parafínového bloku 2 mm sme sa dostali na úroveň 200 μm. V materiáli sme vyhodnocovali výskyt okultných mikrometastáz (subpatologických metastáz), izolovaných nádorových buniek a na základe týchto údajov stanovovali presnosť klasifikácie pN nálezu po rutínnom histopatologickom vyšetrení.
VÝSLEDKY
Z 18 pacientov sa u štyroch zistili mikrometastázy. U jedného pacienta sme zistili 3 mikrometastázy v 3 lymfatických uzlinách na jednej strane krku. Jeden pacient mal okrem mikrometastáz zistené aj izolované nádorové bunky v ďalšej uzline. U ďalších dvoch pacientov sa diagnostikovali iba izolované nádorové bunky, u každého v jednej lymfatickej uzline. Jeden pacient mal duplicitnú malignitu, folikulárny lymfóm G1 v jednej lymfatickej uzline v oblasti IIB. Z 28 krčných disekcií bolo 6 strán po dodatočnom histopatologickom vyšetrení pozitívnych, štyri strany krku s mikrometastázami a 2 strany krku s izolovanými nádorovými bunkami. Incidencia okultných mikrometastáz (subpatologických metastáz) bola 22,2 % na pacienta a 14,3 % na stranu krku. Z 28 krčných disekcií sa získalo a vyšetrilo 600 lymfatických uzlín. Priemerný počet lymfatických uzlín na krčnú disekciu bolo 21,4. Incidencia mikrometastáz na lymfatickú uzlinu bola 1%. Výskyt patologického nálezu na jednu vyšetrenú lymfatickú uzlinu bol 1,7 %, 10/600. Všetky mikrometastázy boli lokalizované v uzline subkapsulárne (100 %). Izolované nádorové bunky sme identifikovali v marginálnych sínusoch lymfatickej uzliny (obr. 1).

Podľa oblastí na krku bol patologický nález lokalizovaný predovšetkým v oblasti IIA, kde sme zistili 5 mikrometastáz, 2 nálezy izolovaných nádorových buniek. V oblasti IIB sa detekovala 1 mikrometastáza u pacienta s T4 karcinómom hrtana s prerastaním cez štítnu chrupku, pričom ostatné lymfatické uzliny boli bez metastatického postihnutia. Prekvapivým bolo zistenie duplicitnej malignity v lymfatickej uzline v oblasti IIB, v ktorej sa zistil folikulárny lymfóm G1. V ostatných lymfatických uzlinách sa metastázy karcinómu nezachytili ani po histopatologickom dovyšetrovaní, pN0. U jedného pacienta s karcinómom okraja tela jazyka T1 bol zistený nález izolovaných nádorových buniek v oblasti IB. V ostatných oblastiach na krku sme patologický nález v lymfatických uzlinách nezaznamenali (tab. 2). Veľkosť mikrometastáz bola od 0,4 mm do 1,4 mm, priemerná veľkosť 0,77 mm (tab. 3).

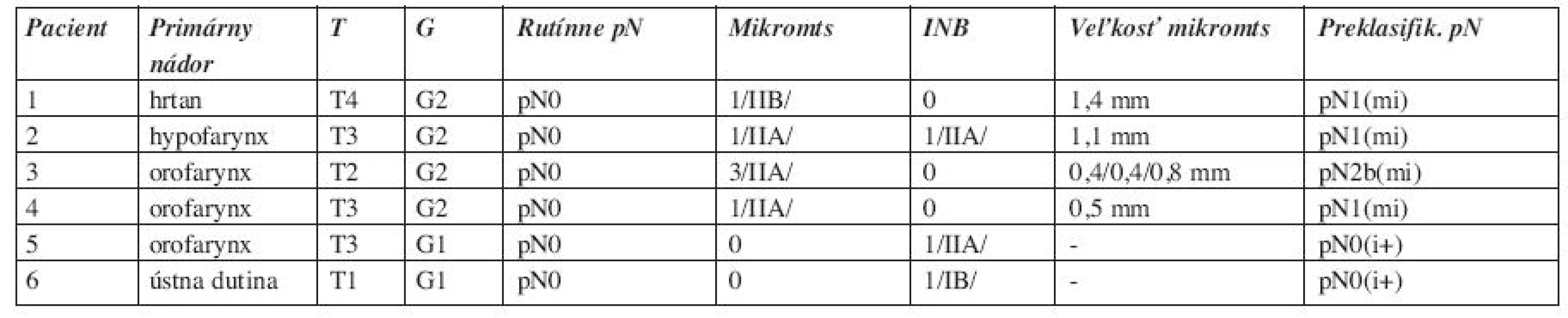
Z 18 pacientov došlo po doexcidovaní materiálu z krčných disekátov k preklasifikovaniu nádorovej choroby u siedmych pacientov. Všetci títo pacienti boli po rutínnom histopatologickom vyšetrení klasifikovaní ako pN0. Nezistili sme ďalší patologický nález v lymfatických uzlinách u pacientov s pN+ po rutínnom histopatologickom vyšetrení. U 4 pacientov, u ktorých sa zistili mikrometastázy, boli traja preklasifikovaní z pN0 na pN1(mi) a jeden z pN0 na pN2(mi). Dvaja pacienti s nálezom izolovaných nádorových buniek boli preklasifikovaní z pN0 na pN0(i+) (tab. 3). Jeden pacient mal zistený folikulárny lymfóm G1 v jednej lymfatickej uzline. Celkovo sme zaznamenali zmenu klasifikácie nádorovej choroby u 7 pacientov, 38,9 %. K zmene klasifikácie pN nálezu došlo u 6 pacientov, 33,3 %, ak rátame aj pN0(i+) nálezy. Zo 14 pN0 pacientov po rutínnom histopatologickom vyšetrení sme preklasifikovali celkovo 6 pacientov, 42,9 %, dvaja pN0(i+), traja pN1(mi) a jeden pN2b(mi). K zmene z pN0 na pN+ došlo u štyroch pacientov, 28,6 %.
DISKUSIA
Pri slizničných karcinómoch hlavy a krku s klinicky negatívnym uzlinovým nálezom zostáva celkovo asi 30% riziko okultných metastáz (28, 30). Peroperačná identifikácia možného metastatického postihnutia lymfatických uzlín na základe veľkosti, zmeny tvaru a konzistencie je nedostatočne presná (14, 22). Najväčšia lymfatická uzlina v regionálnej oblasti primárneho nádoru ešte neznamená najvyššie riziko postihnutia metastázou a predovšetkým mikrometastázou. Väčšie lymfatické uzliny pozorujeme hlavne v oblasti II na podklade zápalových zmien. Zápalové cytokiníny, ako IL 1, 2, 6 a aktivované makrofágy môžu inhibovať adhéziu a proliferáciu nádorových buniek. Preto sa často možno stretnúť s nálezom zväčšených lymfatických uzlín bez znakov nádorovej infiltrácie. Naopak, lymfatické uzliny postihnuté mikrometastázou často bývajú bez zmeny veľkosti a tvaru (7, 17, 20). Okultné metastázy sa najpresnejšie diagnostikujú histopatologickým vyšetrením uzlín z krčných disekátov. Lymfatické uzliny získané z krčných disekátov sa rutinne vyšetrujú jedným alebo dvomi rezmi cez jednu lymfatickú uzlinu, zatiaľ čo väčšia časť lymfatickej uzliny zostáva nevyšetrená. Diagnostická presnosť takto vyšetrených lymfatických uzlín je pomerne nízka (5, 6, 10, 17, 30). Preto po negatívnom rutinnom histopatologickom vyšetrení zostáva určité percento okultných mikrometastáz, ktoré neboli detekované. Podľa TNM klasifikácie zhubných nádorov, 6. vydanie z roku 2002, má histopatologické vyšetrenie pN0 pri selektívnej krčnej disekcii štandardne zahrňovať 6 alebo viac lymfatických uzlín. Histopatologické vyšetrenie pri radikálnej alebo modifikovanej krčnej disekcii má štandardne zahrňovať 10 a viac lymfatických uzlín. Podľa tejto klasifikácie však nie je presne definované koľko rezov sa vyžaduje cez lymfatickú uzlinu na stanovenie histopatologickej TNM klasifikácie. Sériové, alebo semisériové rezy cez lymfatickú uzlinu zvyšujú presnosť diagnostiky okultných mikrometastáz. Čím nižší je interval rezov, tým je vyšetrenie senzitívnejšie (17). Veľmi nízky interval rezov je však spojený s výraznou časovou aj finančnou náročnosťou, pričom diagnostický prínos nemusí byť adekvátny vynaloženej námahe. Uplatňovanie imunohistochemického vyšetrenia, predovšetkým s farbením na cytokeratíny, podľa viacerých autorov prispieva k zlepšeniu diagnostiky mikrometastáz (1, 20, 32). Kwon a spol. (20) udávajú, že v desiatich zo 14 dodatočne pozitívnych lymfatických uzlín bolo vyšetrenie hematoxylin-eosinom nedostatočné na detekciu okultných mikrometastáz. Rovnaké zistenie tiež podporuje práca Xu a spol. (32). Bolo to ovplyvnené aj nízkou diferenciáciou nádorových buniek, ktoré niekedy ťažko oddiferencovať od lymfocytov a histiocytov. Upozorňujú tiež, že cytokeratín pozitívne bunky v lymfatických uzlinách ešte nemusia byť metastatické nádorové bunky. Rôzne epiteliálne inklúzie v lymfatických uzlinách, ako ektopické salivárne inklúzie, mezoteliálne inklúzie a metastatické tyroidné folikuly môžu byť cytokeratín pozitívne. Tu je potrebné morfologické porovnanie s malígnymi skvamocelulárnymi bunkami na podklade zvýšeného jadrovo-cytoplazmatického pomeru a pleomorfizmu (20). Na druhej strane Hamakava a spol. (17) nezistili signifikantné diagnostické zlepšenie imunohistochemickým vyšetrením. Vysvetľujú to precíznym vyšetrovaním HE rezov. Molekulárne metódy, ako genetická diagnostika mikrometastáz polymerázovou reťazovou reakciou s reverznou transkriptázou (RT-PCR), ponúkajú vysoko senzitívne informácie. Kvantitatívna reverzná transkriptáza s polymerázovou reťazovou reakciou (QRT-PCR) dokáže identifikovať jednu nádorovú bunku na pozadí 10 miliónov lymfoidných buniek, čím prekračuje senzitivitu iných metód (2). Nevýhodou je deficit morfologickej informácie. Rovnako identifikácia optimálneho tumorového markera je stále vo vývoji (2, 13, 25).
Pri 200 μm intervaloch HE rezov a s využitím imunohistochemického farbenia na cytokeratíny sme v našej práci zistili incidenciu okultných mikrometastáz 22,2 % na pacienta, 14,3 % na stranu krku, ale len 1 % v prepočte na vyšetrené lymfatické uzliny. Výsledky sú porovnateľné s inými autormi pri obdobnej technike vyšetrovania. Hamakawa a spol. (17) referujú o incidencii 21,9 % na pacienta a 4,2 % na vyšetrené lymfatické uzliny. Interval semisériových rezov bol u väčšiny 200 μm. Kwon a spol. (20) udávajú incidenciu 18,8 % na pacienta a 0,8 % na vyšetrené lymfatické uzliny. Diagnostiku zvýšili predovšetkým imunohistochemickým vyšetrením. Nízku incidenciu mikrometastáz zaznamenala Woolgar (31), napriek vyšetrovaniu sériovými rezmi v intervale 100 μm. Pri 6874 vyšetrených lymfatických uzlín zistila incidenciu mikrometastáz 7,8 % na pacienta a 0,2 % na vyšetrené uzliny. Veľký počet vyšetrených lymfatických uzlín zhodnotili aj van den Brekel a spol. (30), ktorí vyšetrili 3092 uzlín sériovými rezmi v intervale 3-4 μm. Dosiahli incidenciu mikrometastáz 2,2 % na vyšetrenú uzlinu, no 37 % na stranu krku. Incidenciu mikrometastáz prehodnocovali Enepekides a spol. (9) v skupine 44 pacientov s karcinómami ústnej dutiny s pN0 nálezom po konvenčnom histopatologickom vyšetrení s farbením hematoxylin-eosinon s využitím imunoperoxidázového farbenia na cytokeratíny. U 3 pacientov (7 %) zistili ďalšiu mikrometastázu skvamocelulárneho karcinómu. Kocaturk a spol. (19) po dovyšetrovaní rovnakou technikou v súbore 22 pacientov s karcinómom supraglotis s pN0 po rutínnom vyšetrení detekovali ďalšie mikrometastázy u 3 pacientov (13,6 %).
Incidencia mikrometastáz na vyšetrenú lymfatickú uzlinu sériovým alebo semisériovým rezmi s alebo bez imunohistochemického vyšetrenia s cytokeratínmi je 0,2 % - 4,4 % (1, 9, 17, 20, 30, 31), v porovnaní s molekulárnou analýzou s rôznymi tumorovými markermi, kde je incidencia od 2,6 % do 21 % (3, 15, 16, 21, 25, 33).
Podľa niektorých autorov je incidencia mikrometastáz vyššia u pacientov s nízkou diferenciáciou nádorových buniek primárneho karcinómu (20). V našej práci mali pacienti predovšetkým dobre a stredne diferencovaný karcinóm a takúto súvislosť sme nezaznamenali.
Lokalizácia mikrometastáz býva predovšetkým v marginálnych sínusoch subkapsulárne (64 – – 76 %), zriedkavejšie v medulárnych sínusoch (24 – 32 %) (17, 30, 31). V našom súbore boli všetky mikrometastázy lokalizované subkapsulárne (100 %). Táto lokalizácia sa vysvetľuje predĺženým intrakapsulárnym priebehom aferentných lymfatických kanálikov a veľkým množstvom chlopní v kanálikoch v blízkosti puzdra lymfatickej uzliny (31). Výskyt mikrometastáz podľa oblastí na krku odpovedal zloženiu súboru pacientov podľa lokalizácie primárneho nádoru. V našom prípade bola väčšina mikrometastáz a izolovaných nádorových buniek (INB) v oblasti IIA, pri karcinóme ústnej dutiny sme diagnostikovali INB v oblasti IB.
Následkom precíznejšej diagnostiky mikrometastáz došlo aj k upresneniu klasifikácie pN nálezu pacientov v našom súbore. Nedošlo k zmene klasifikácie u 4 pacientov s pN+ nálezom. Ale u 14 pacientov s pN0 nálezom bola zmenená klasifikácia na pN1(mi) u troch a na pN2b(mi) u jedného, 28,6 %. V porovnaní s inými autormi je podľa techniky diagnostiky zmena pN0 na pN+ 15,9 % - 40 % (1, 17, 20, 30, 33).
Pri karcinómoch hlavy a krku hodnotili prognostický význam mikrometastáz v regionálnych lymfatických uzlinách viacerí autori (4, 9, 17, 21, 31, 32, 33).
Woolgar (31) v pooperačnom sledovaní (2-6 rokov) pacientov pri karcinómoch ústnej dutiny nezistila rozdiel vo výsledkoch medzi skupinou pacientov bez metastáz a skupinou pacientov iba s mikrometastázami. U žiadneho zo 14 pacientov v skupine iba s mikrometastázami nedošlo k rekurencii na krku. Enepekides a spol. (9) rovnako nedokázali štatisticky významnú spojitosť medzi pN1 nálezom po dôkaze mikrometastáz a zhoršenou lokoregionálnou kontrolou alebo prežívaním. U pacientov s karcinómom ústnej dutiny s dodatočne zistenými mikrometastázami (imunohistochemické vyšetrenie na cytokeratíny) nedošlo počas minimálneho sledovanie 2 rokov k regionálnej recidíve. Kocaturk a spol.(19) v súbore 22 pacientov s karcinómom supraglotis a pôvodným pN0 nálezom po imunohistochemickom vyšetrení na cytokeratíny zistili mikrometastázy u 3 pacientov (13,6 %), no ani u jedného s preklasifikovaným pN1 nálezom nezistili regionálnu recidívu choroby pri priemernom čase sledovania 13 mesiacov. V týchto prípadoch, okrej toho, že bol súbor pomerne malý, treba zvážiť kuratívny efekt samotnej elektívnej krčnej disekcie v prípade pN1 nálezu bez ECS. Pretože dodatočný nález mikrometastáz nezmenil liečebný plán na krku, títo autori neodporúčajú rutínne IHC lymfatických uzlín z KD.
Zo súboru 44 pacientov s karcinómom ústnej dutiny, pôvodne klasifikovaných ako pN0, bolo 7 preklasifikovaných na pN+ (6 pacientov na pN1, 1 pacient na pN2b) v štúdii Hamakawu a spol. (17). Incidencia rekurencie alebo vzdialených metastáz v skupine preklasifikovaných na pN+ bola 57,1 % a oproti skupine pacientov, ktorí zostali, pN0 bola 13,5 %. Rozdiel bol štatisticky významný (p=0,02).
Pacienti s karcinómom ústnej dutiny s viacpočetnými mikrometastázami alebo mikrometastázami lokalizovanými v nižších oblastiach krku geneticky diagnostikovanými, majú podľa práce Yamazakiho a spol. (33) horšiu prognózu a sú indikovaní na pooperačnú adjuvantnú liečbu.
Neliečené mikrometastázy v závislosti od oneskorenia liečby budú progredovať do klinicky manifestnej choroby. Viacpočetné mikrometastázy a lokalizácia mikrometastáz v lymfatických uzlinách v nižších oblastiach krku odrážajú vyššiu biologickú metastatickú aktivitu nádorových buniek. Preto aj bez ohľadu na dôkaz prognostického významu mikrometastáz je odporúčaná ich diagnostika a liečba (12, 17, 30, 33).
U pacientov s karcinómom hlavy a krku a pN0 nálezom Nieuwenhuis a spol. (21) detegovali mikrometastázy pomocou RT-PCR, kde ako marker bol využitý skvamocelulárny špecifický antigén E48(Ly6D). U 23 pN0 pacientov bola prítomnosť markeru E48 v lymfatických uzlinách signifikantne spojená so zhoršených prežívaním vo vzťahu k základnej chorobe v porovnaní s pN0 pacientami s E48 negatívnymi uzlinami.
V súbore 20 pacientov s karcinómom supraglotis Xu a spol. (32) poukázali na štatisticky významný rozdiel v zníženom celkovom prežívaní u pacientov, u ktorých dokázali ďalšie mikrometastázy imunohistochemicky na CK19 a RT-PCR, kde ako molekulárny marker použili stratu heterozygozity.
Hoci stále pribúda prác s dôkazom klinického a prognostického významu mikrometastáz u pacientov s karcinómom hlavy a krku, definitívne objasnenie problému a následné štandardné odporúčania na diagnostiku a liečbu sa očakáva z ďalších prospektívnych štúdií s väčším súborom pacientov. Zlepšená diagnostika pN nálezu nám umožňuje presnejšie selektovať pacientov, ktorí by mali benefit z pooperačnej adjuvantnej liečby, či už rádioterapie alebo rádiochemoterapie.
Interval 200 μm HE rezov so súčasným využitím imunohistochemického farbenia na cytokeratíny, ako sme realizovali v našej práci, poskytuje pomerne detailné informácie o postihnutí regionálnych lymfatických uzlín. No hoci tento interval nie je veľmi malý, v dennej histopatologickej laboratórnej praxi ostáva stále nepraktický. Detekcia izolovaných nádorových buniek má význam z hľadiska ich dokumentácie, ktorá by mala byť porovnateľná s inými pracoviskami a pre budúce zhodnotenie ich prognostického významu. Zatiaľ však nie sú dôkazy, že by ich detailná identifikácia priniesla benefit v plánovaní liečby pacienta. Priemerný rozmer mikrometastáz, zistený v našom súbore, bol 0,77 mm. Vzhľadom na priemerný rozmer mikrometastáz sa javí ako optimálny interval rezov 1 mm (17). Pri tomto intervale by mala byť diagnostika mikrometastáz dostatočne presná, tak ako aj klasifikácia pN nálezu. Časová a finančná náročnosť pri takomto intervale rezov sa javí ako akceptovateľná pri diagnostickom benefite pre pacienta (17).
V poslednom období stále nadobúda väčší význam biopsia sentinelovej lymfatickej uzliny. Výhodou je okrem zníženia morbidity pri negatívnej sentinelovej uzline aj presnejšie štádium uzlinového nálezu. Detailnejšie histopatologické metódy sa môžu ľahšie uplatniť pri vyšetrení malého počtu sentinelových uzlín, ako pri vyšetrení všetkých uzlín krčného disekátu (24, 27, 28). Ďalším posunom je tiež využitie molekulárnej analýzy. Táto metóda ponúka okrem výhody vyššej sentitivity aj možnosť vyšetrenia nie iba jedného rezu, ale tiež celej lymfatickej uzliny v jednom vyšetrení (12).
ZÁVER
Z výsledkov našej práce ako aj z citovanej literatúry možno konštatovať, že incidencia okultných mikrometastáz pri karcinómoch hlavy a krku je vyššia ako je diagnostikovaná rutínnym histopatologickým vyšetrením. Hoci štandardné odporúčania v prípade diagnostiky mikrometastáz alebo izolovaných nádorových buniek ešte čakajú na rozsiahlejšie štúdie, jednotná klasifikácia malých nádorových depozitov v lymfatických uzlinách by sa mala využívať už dnes, čím sa vytvoria podmienky na porovnateľné hodnotenie výsledkov ich incidencie a klinického dopadu. Sériové, alebo semisériové rezy, doplnené o imunohistochemické vyšetrenie s cytokeratínmi, pre svoju pracnosť a finančnú náročnosť ťažko odporúčať v rutínnej praxi. Konsenzom by mohol byť 1mm interval rezov. Touto technikou by sa mohli presnejšie identifikovať pacienti na pooperačnú adjuvantnú liečbu. Lepšia dostupnosť molekulárnej analýzy by napomohla k riešeniu tohto problému. Na druhej strane biopsia sentinelovej lymfatickej uzliny znižuje množstvo materiálu potrebného na vyšetrenie, čím sa môžu uplatniť aj detailnejšie histopatologické alebo molekulárne metódy.
MUDr. Patrik Štefanička, Ph.D.
I. ORL
klinika LF UK, FNsP a SZUAntolská
11
851
07 Bratislava
Slovenská
republika
e-mail:
patrikstefanicka@yahoo.com
Sources
1. Barrera, J. E., Miller, M. E., Said, S., Jafek, B. W., Campana, J. P., Shroyer, K. R.: Detection of occult cervical micrometastases in patients with head and neck squamous cell cancer. Laryngoscope, 113, 2003, s. 892-896.
2. Becker, M. T., Shores, C. G., Yu, K. K., Yarbrough, W. G.: Molecular assay to detect metastatic head and neck squamous cell carcinoma. Arch. Otolaryngol Head Neck Surg., 130, 2004, s. 21-27.
3. Brennan, J. A, Mao, L, Hruban, R. H., Boyle, J. O., Eby, Y. J., Koch, W. M, Goodman, S. N., Sidransky, D.: Molecular assessment of histopathological staging in squamous cell carcinoma of the head and neck. N. Engl. J. Med., 332, 1995, 7, s. 429-435.
4. Colnot, D. R., Nieuwenhuis, E. J. C. , Kuik, D. J., Leemans, C. R., Dijkstra, J., Snow, G. B., van Dongen, G., Brakenhoff, R. H.: Clinical significance of micrometastatic cells detected by E48 (Ly-6D) reverse transcription – polymerase chain reaction in bone marrow of head and neck cancer patients. Clin. Cancer Res., 10, 2004, 7827-7833.
5. Devaney, S. L., Ferlito, A., Rinaldo, A., Devaney, K. O.: Pathologic detection of occult metastases in regional lymph nodes in patients with head and neck cancer. Acta Otolaryngol, 120, 2000, s. 344-349.
6. Devaney, S. L., Ferlito, A., Rinaldo, A., Devaney, K. O.: The pathology of neck dissection in cancer of the larynx. ORL J. Otorhinolaryngol Relat. Spec., 62, 2000, 4, s. 204-211.
7. Don, D. M., Anzai, Y., Lufkin, R. B., Fu, Y. S., Calcaterra, T. C.: Evaluation of cervical lymph node metastases in squamous cell carcinoma of the head and neck. Laryngoscope, 105, 1995, s. 669-674.
8. Elsheikh, M. N., Rinaldo, A., Hamakawa, H., Mahfouz, M. E., Rodrigo, J. P., Brennan, J., Devaney, K. O., Grandis, J. R, Ferlito, A.: Importance of molecular analysis in detecting cervical lymph node metastasis in head and neck squamous cell carcinoma. Head Neck, 28, 2006, s. 842-849.
9. Enepekides, D. J., Sultanem, K., Nguyen, C., Shenouda, G., Black, M. J., Rochon, L.: Occult cervical metastases: immunoperoxidase analysis of the pathologically negative neck. Otolaryngol Head Neck Surg., 120, 1999, s. 713-717.
10. Ferlito, A., Devaney, K. O., Rinaldo, A., Devaney, S. L., Carbone, A.: Micrometastases: have they an impact on prognosis? Ann. Otol. Rhinol. Laryngol, 108, 1999, 1185-1189.
11. Ferlito, A., Rinaldo, A., Devaney, K. O., MacLennan, K., Myers, J. N., Petruzzelli, G. J., Shaha, A. R., Genden, E. M., Johnson, J. T., Carvalho, M. B., Myers, E. N.: Prognostic significance of microscopic and macroscopic extracapsular spread from metastatic tumor in the cervical lymph nodes. Oral Oncology, 38, 2002, s. 747-751.
12. Ferlito, A., Rinaldo, A., Devaney, K. O., Nakashiro, K., Hamakawa, H.: Detection of lymph node micrometastases in patients with squamous carcinoma of the head and neck. Eur Arch. Otorhinolaryngol, 256, 2008, 1147-1153.
13. Ferris, R. L., Xi, L., Raja, S., Hunt, J. L., Wang, J., Gooding, W. E., Kelly, L,. Ching, J., Luketich, J. D., Godfrey, T. E.: Molecular staging of cervical lymph nodes in squamous cell carcinoma of the head and neck. Cancer Res., 65, 2005, s. 2147-2156.
14. Finn, S., Toner, M., Timon, C.: The node-negative neck: accuracy of clinical intraoperative lymph node assessment for metastatic disease in head and neck cancer. Laryngoscope, 112, 2002, s. 630-633.
15. Hamakawa, H., Fukuzumi, M., Bao, Y., Sumida, T., Kayahara, H., Onishi, A., Sogawa, K.: Keratin mRNA for detecting micrometastasis in cervical lymph nodes of oral cancer. Cancer Letters, 160, 2000, s. 115-123.
16. Hamakawa, H., Fukizumi, M., Bao, Y., Sumida, T, Onishi, A., Tanioka H., Sato, H., Yumoto, E.: Genetic diagnosis of micrometastasis based on SCC antigen mRNA in cervical lymph nodes of head and neck cancer. Clin. Exp. Metastasis, 17, 1999, 7, s. 593-599.
17. Hamakawa, H., Takemura, K., Sumida, T., Kayahara, H., Tanioka, H., Sogawa, K.: Histological study on pN upgrading of oral cancer. Virchows Arch., 437, 2000, s. 116-121.
18. Hermanek, P., Hutter, R. V., Sobin, L. H., Wittekind, C.: Classification of isolated tumor cells and micrometastasis. Cancer, 86, 1999, s. 2668-2673.
19. Kocaturk, S., Yilmazer, D., Onal, B., Erkam, U., Urunal, B.: Do micrometastases detected with cytokeratin immunoperoxidase reactivity affect the treatment approach to neck in supraglottic cancers? Otolaryngol Head Neck Surg., 128, 2003, s. 407-411.
20. Kwon, S. Y., Kim, H. J., Woo, J. S., Jung, K. Y., Kim, I.: The usefulness of cytokeratin immunohistochemistry in detection of lymph node micrometastasis in neck dissection specimens. Otolaryngol Head Neck Surg., 131, 2004, s. 300-306.
21. Nieuwenhuis, E. J., Leemans, C. R., Kummer, J. A., Denkers, F., Snow, G. B., Brakenhoff, R. H.: Assessment and clinical significance of micrometastases in lymph nodes of head and neck cancer patients detected by E48 (Ly-6D) quantitative reverse transcription - polymerase chain reaction. Lab. Invest, 83, 2003, s. 1233-1240.
22. Rassekh, C. H., Johnson, J. T., Myers, E. N.: Accuracy of intraoperative staging of the N0 neck in squamous cell carcinoma. Laryngoscope, 105, 1995, 12, s. 1334-1336.
23. Rinaldo, A., Devaney, K. O., Ferlito, A.: Immunohistochemical studies in the identification of lymph node micrometastases in patients with squamous cell carcinoma of the head and neck. ORL J. Otorhinolaryngol Relat. Spec., 66, 2004, s. 38-41.
24. Ross, G. L., Soutar, D. S., MacDonald, D. G., Shoaib, T., Camilleri, I., Roberton, A. G., Sorensen, J. A., Thomsen, J., Grupe, P. et al: Sentinel lymph node biopsy in head and neck cancer: Preliminary results of a multicenter trial. Ann. Surg. Oncol., 11, 2004, s. 690-696.
25. Shores, C. G., Yin, X., Funkhouser, W., Yarbrough, W.: Clinical evaluation of a new molecular method for detection of micrometastases in head and neck squamous cell carcinoma. Arch. Otolaryngol Head Neck Surg., 130, 2004, s. 937-942.
26. Sobin, L. H., Wittekind, C. H.: TNM klasifikácia zhubných nádorov. 6. vyd., Košice, ETC GRAFO, 2002, 178 s., ISBN 80-968395-5-1
27. Stoeckli, S. J., Alkureishi, L. W. T., Ross, G. L.: Sentinel node biopsy for early oral and oropharyngeal squamous cell carcinoma. Eur Arch. Otorhinolaryngol, 266, 2009, s. 787-793.
28. Stoeckli, S. J.: Sentinel node biopsy for oral and oropharyngeal squamous cell carcinoma of the head and neck. Laryngoscope, 117, 2007, s. 1539-1551.
29. van den Brekel, M. W., Castelijns, J. A., Snow, G. B.: Diagnostic evaluation of the neck. Otolaryngol Clin. North Am., 31, 1998, 4, s. 601-620.
30. van den Brekel, M. W., van der Waal, I., Meijer, C. J., Freeman, J. L., Castelijns, J. A., Snow, G. B.: The incidence of micrometastases in neck dissection specimens obtained from elective nech dissections. Laryngoscope, 106, 1996, 8, s. 987-991.
31. Woolgar, J. A.: Micrometastasis in oral/oropharyngeal squamous cell carcinoma: incidence, histopathological features and clinical implications. Br. J. Oral Maxillofac. Surg., 37, 1999, 181-186.
32. Xu, Y., Zhao, X., Guan, M., Li, B., Zhou, Y., Zhou, F.: Determination of lymph node micrometastases in patients with supraglottic carcinoma. Acta Oto-Laryngologica, 127, 2007, s. 1188-1195.
33. Yamazaki, Y., Chiba, I., Hirai, A., Satoh, C., Sakakibara, N., Notani, K., Iizuka, T., Totsuka, Y.: Clinical value of genetically diagnosed lymph node micrometastasis for patients with oral squamous cell carcinoma. Head Neck, 27, 2005, 8, s. 676-681.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)Article was published in
Otorhinolaryngology and Phoniatrics

2011 Issue 1
Most read in this issue
- Inhalační trauma – historie, současnost a budoucnost
- Výskyt komplikácií po rekonštrukcii blany bubienka
- Laryngotracheoezofageální rozštěp
- Perkutánna endoskopická gastrostómia v liečbe pacientov s pokročilými nádormi hlavy a krku
