Papilárny karcinóm štítnej žľazy: Analýza veľkosti primárneho tumoru, infiltrácie puzdra štítnej žľazy a lymfangioinvázie vzhľadom k lokoregionálnemu metastázovaniu a veku
Papillary Thyroid Carcinoma: Analysis of the Size of the Primary Tumor, Infiltration of the Thyroid Capsule and Lymfangioinvasiona Due to Metastatic Involvment of Regional Lymph Nodes and Age
Introduction:
In patients with papillary carcinoma of thyroid gland TNM classification is used to asses clinical stage, with age of 45 years being one of the basic criteria. The aim of this study was to analyze the size of the primary tumor, capsule infiltration, invasion of regional lymphatic vessels, multifocal disability and metastatic involvement of regional lymph nodes of the neck with respect to the 45 year age limit.
Methods:
In a retrospective study we did a statistical analysis of a group of 336 patients suffering from papillary thyroid carcinoma. The group was divided into 135 patients under 45 years of age and 201 patients over 45 years of age.
Results:
When comparing the group of patients of age under 45 years and over 45 years we have found the metastatic involvement of cervical lymph nodes (N1) to be 54,1 % vs. 26,9 % of patients respectively, P<0.001 (P=0.000072) and multifocal involvement in 31,9% vs. 25,9 % of patients respectively , P<0.05 (P=0.025). In the group under 45 years we have found the size of the tumor to be ≥1cm significantly more often in the N1 subgroup, P<0.01 (P=0.0015). In patients older than 45 years there was no difference in size of tumor comparing N1 and N0 subgroups. In the group of patients under 45 years of age was statistically higher frequency of lymphangioinvasion in N1 subgroup, P<0.01 (P=0.0063). More frequent infiltration of the capsule of thyroid gland in the N1 subgroup was in both age groups, under 45 years P<0.001 (P=0.0000001) as well as in the group of over 45 years P<0.001 (P=0.0008).
Conclusion:
In the group of patients with papillary thyroid carcinoma under 45 years of age, compared to the group of patients over 45 years of age, we have noted significantly higher incidence of metastatic involvement of regional lymph nodes and multifocal involvement. In younger patients with N1 we noted higher lymphangioinvasion and tumor size over 10 mm.
Keywords:
papilary thyroid carcinoma, age , regional lymph nodes involvement, risk factors
Authors:
M. Sičák 1; J. Sojak 1,2; M. Slašťan 3; A. Kališ 4
Authors‘ workplace:
Slovenská zdravotnícka univerzita v Bratislave, Katolícka univerzita v Ružomberku, Klinika otorinolaryngológie a chirurgie hlavy a krku, Ústredná vojenská nemocnica – Fakultná nemocnica v Ružomberku
1; Univerzita Komenského v Bratislave, Jesseniova lekárska fakulta v Martine, Ústav patologickej fyziologie
2; Univerzita Komenského v Bratislave, Jesseniova lekárska fakulta v Martine, Ústav lekárskej biochemie
3; Katolícka univerzita v Ružomberku, Ústav patologickej anatómie, Ústredná vojenská nemocnica – Fakultná nemocnica v Ružomberku
4
Published in:
Otorinolaryngol Foniatr, 62, 2016, No. 4, pp. 224-231.
Category:
Original Article
Overview
Cieľ:
Jedným zo základných kritérií stagingu v TNM klasifikácii pacientov s papilárnym karcinómom štítnej žľazy je veková hranica 45 rokov. Zamerali sme sa na analýzu veľkosti primárneho tumoru, infiltrácie puzdra štítnej žľazy, lymfangioinvázie, multifokálneho a metastatického postihnutia regionálnych krčných lymfatických uzlín vzhľadom k vekovej hranici 45 rokov.
Metodika:
V retrospektívnej štúdii sme štatisticky vyhodnocovali súbor 336 pacientov postihnutých papilárnym karcinómom štítnej žľazy rozdelený na skupinu 135 pacientov do 45 rokov a skupinu 201 pacientov nad 45 rokov.
Výsledky:
Pri porovnaní skupín pacientov do 45 rokov a nad 45 rokov veku sme metastázovanie do regionálnych lymfatických uzlín (N1) diagnostikovali v 54,1 % vs. 26,9 % pacientov, P<0,001 (P=0,000072) a multifokálne postihnutie v 31,9 % vs. 25,9 % pacientov, P<0,05 (P=0,025). V skupine pacientov pod 45 rokov bola veľkosť tumoru ≥1cm signifikantne častejšia v podskupine N1 v porovnaní s pacientmi bez metastáz (N0), P<0,01 (P=0,0015). V skupine pacientov nad 45 rokov sme nezaznamenali u pacientov s MTS postihnutím (N1) signifikantne častejšie veľkosť tumoru ≥1cm (P = 0,201). Častejšiu pozitívnu infiltrácia puzdra štítnej žľazy v podskupine N1 sme zaznamenali v oboch vekových skupinách, v skupine pacientov pod 45 rokov, P<0,001 (P=0,0000001) aj v skupine pacientov nad 45 rokov, P<0,001 (P=0,0008). V skupine pacientov pod 45 rokov sme v N1 podskupine pozorovali častejšiu pozitívnu lymfangioinváziu, P<0,01 (P=0,0063).
Záver:
V skupine pacientov s papilárnym karcinómom mladších ako 45 rokov sme v porovnaní s pacientmi nad 45 rokov zaznamenali signifikantne vyšší výskyt metastatického postihnutia regionálnych krčných lymfatických uzlín (N1) a multifokálneho postihnutia. V N1 podskupine do 45 rokov bol signifikantne častejší výskyt tumoru nad 10 mm a častejšia lymfangioinvázia v porovnaní s pacientami nad 45 rokov, kde výskyt týchto rizikovýchh faktorov nemal súvis s prítomnosťou metastáz.
Kľúčové slová:
papilárny karcinóm štítnej žľazy, vek , regionálne metastázy, rizikové faktory
ÚVOD
Pri malígnych nádoroch štítnej žľazy sa najčastejšie stretávame s papilárnym karcinóm štítnej žľazy (ďalej len PTC), ktorý radíme medzi diferencované karcinómy (ďalej len DTC) vyrastajúce z folikulárnych epiteliálnych buniek štítnej žľazy. Spomedzi DTC ide v 85 % o papilárny karcinóm a jeho varianty, v 10 % o folikulárny karcinóm, v 3 % o Hürthleho (oxyfilný) karcinóm a zvyšok tvoria agresívnejšie formy diferencovaných karcinómov (6). TNM klasifikácia odlišuje štyri hlavné histopatologické typy karcinómov štítnej žľazy: papilárny (vrátane folikulárneho variantu), folikulárny (vrátane Hürthleho karcinómu), medulárny a nediferencovaný (anaplastický) karcinóm.
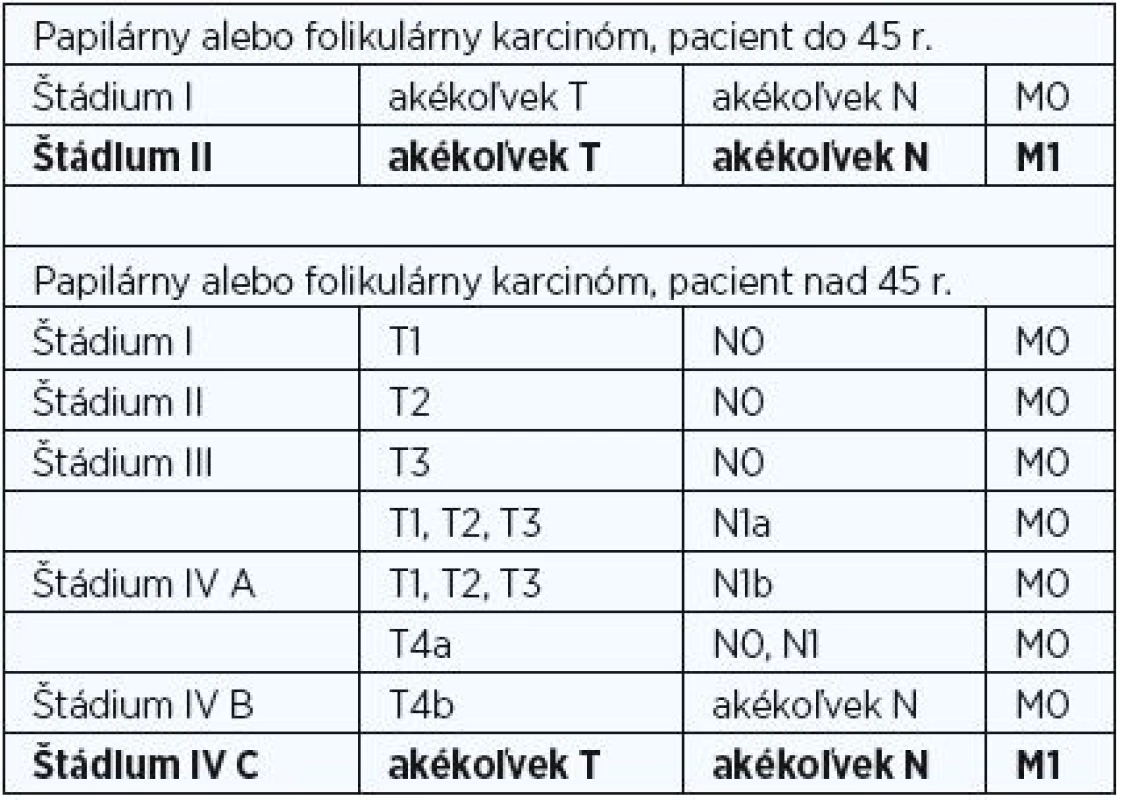
K stagingu PTC využívame medzinárodne akceptovanú TNM klasifikáciu, v ktorej je veková hranica 45 rokov jedným z hlavných kritérií na určenie klinického štádia ochorenia (tab. 1) (4). Veľkosť primárneho nádoru (T) a prítomnosť regionálnych metastáz (N) je pre staging určujúca len v skupine pacientov starších ako 45 rokov. Mladší pacienti bez vzdialených metastáz (M0) sú zaradení do I. štádia, a to bez ohľadu na T a N, pacienti so vzdialenými metastázami (M1) sú zaradení do II. štádia ochorenia.
T1 – nádor ≤ 2 cm vnútrožľazový; T2 – nádor >2 do 4 cm vnútrožľazový; T3 – tumor > 4 cm alebo minimálne šírenie; T4a – nádor infiltrujúci podkožie, hrtan, tracheu, pažerák, n. recurrens; T4b – nádor infiltrujúci prevertebrálnu fasciu, cievy mediastina, a.carotis; N0 – bez metastáz v regionálnych lymfatických uzlinách; N1a – metastázy v régiu VI; N1b – metastázy v ostatných régiách; M0 – vzdialené metastázy neprítomné, M1 – vzdialené metastázy
V klinickej praxi ale okrem veku ovplyvňujú zaradenie pacientov do skupiny s takzvaným vysokým alebo nízkym prognostickým rizikom (high risk verzus low risk) ďalšie rizikové faktory – prítomnosť regionálnych metastáz, veľkosť tumoru, multifokálny výskyt, infiltrácia púzdra štítnej žľazy, lymfangioinvázia, histopatologické a genetické parametre.
Priaznivejší TNM staging mladších pacientov vychádza z prognostického významu veku pre dlhodobé prežívanie pacientov s PTC. Nehovorí však nič o kvalite ich života či potrebe a rozsahu terapeutických výkonov u týchto pacientov. Cieľom práce bolo overiť si v našom klinickom materiáli či je nízky vek pacienta spojený s nižším výskytom rizikových faktorov, teda či priaznivejší TNM staging mladších pacientov s PTC koreluje s nižšou radikalitou a rozsahom liečby v tejto vekovej skupine. Zamerali sme sa na analýzu veľkosti primárneho tumoru, multifokálneho výskytu, infiltrácie puzdra štítnej žľazy, lymfangioinvázie a metastatického postihnutia regionálnych krčných lymfatických uzlín vzhľadom k vekovej hranici 45 rokov. Tieto faktory majú priamy vplyv na rozsah primárnej chirurgickej liečby a na indikáciu adjuvantnej liečby rádioaktívnym jódom.
MATERIÁL A METODIKA
Vykonali sme retrospektívnu analýzu súboru pacientov operovaných na našej klinike počas 13-ročného intervalu v rozmedzí rokov 2003 až 2015.
Z celkového počtu 4001 pacientov operovaných pre ochorenie štítnej žľazy bolo 395 (9,9 %) pacientov postihnutých zhubným nádorom štítnej žľazy. V 336 prípadoch (8,4 %) sa jednalo o PTC -v 276 prípadoch sa jednalo o konvenčný variant, v 44 prípadoch o folikulárny variant a v 16 prípadoch o onkocytárny variant PTC.
Predmet našej analýzy je súbor 336 pacientov s histologicky verifikovaným PTC. Tento súbor sme rozdelili na skupinu 135 pacientov mladších ako 45 rokov a skupinu 201 pacientov starších ako 45 rokov.
V práci poskytujeme prehľadné údaje o vekovom zložení pacientov, pohlavnom zastúpení, prítomnosti rizikových faktorov (veľkosť primárneho tumoru, infiltrácia púzdra štítnej žľazy, lymfangioinvázia, postihnutie regionálnych krčných lymfatických uzlín a multifokálny výskyt tumoru v štítnej žľaze) potvrdených definitívnym histopatologickým vyšetrením, a to aj vzhľadom k veku pacienta.
Nie je zohľadnené či histologický nález pochádza z primooperácie, alebo reoperácie, respektíve či bol pacient na našu kliniku prijatý za účelom operácie, alebo reoperácie s N0, alebo N1 statusom, keďže prípadná predchádzajúca operácia ŠŽ tieto faktory neovplyvňuje.
Výsledky sme interpretovali využitím relatívnej početnosti a jednorozmerného chí-kvadrátového testu s Yatesovou korekciou na hladine signifikancie 0,05, 0,01 a 0,001.
Rozsah chirurgickej liečby
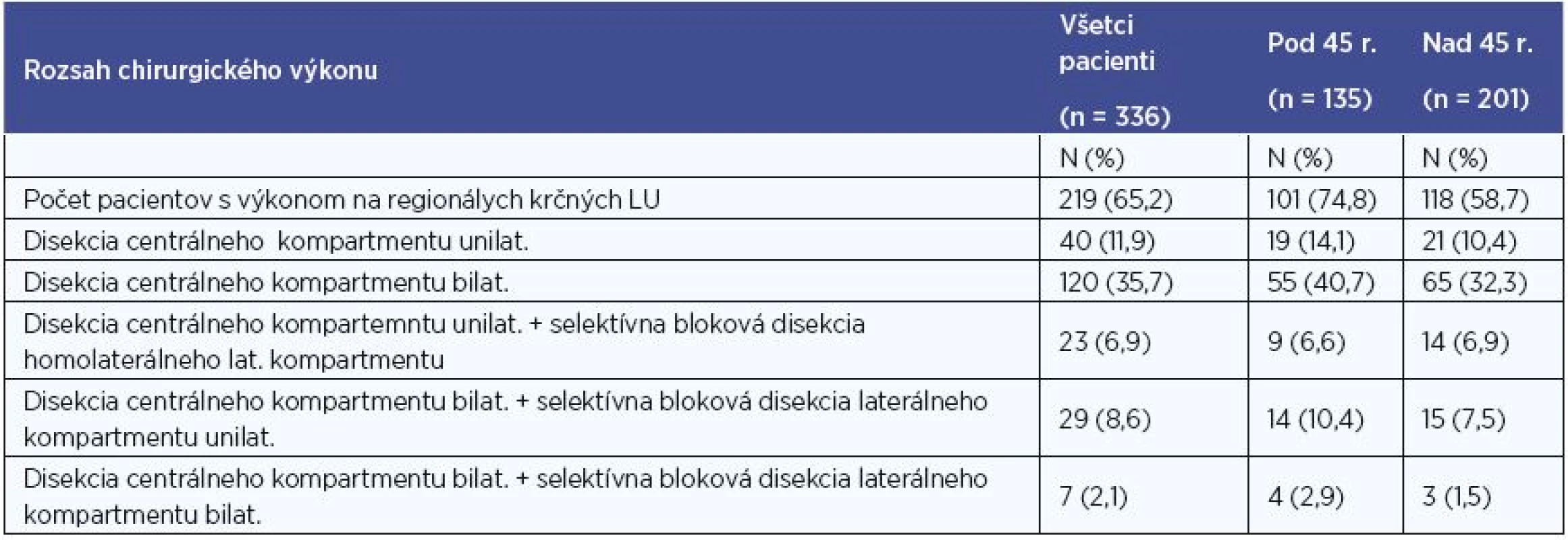
Z celého súboru 336 pacientov s PTC podstúpilo 313 pacientov (93 %) totálnu tyreoidektómiu (ďalej len TTE) ako primooperáciu v jednom kroku, 219 pacientov (65 %) podstúpilo niektorú z foriem elektívnej či terapeutickej disekcie krčných lymfatických uzlín (ďalej len LU) (minimálne v rozsahu VI. skupiny LU unilaterálne), z nich 156 pacientov (46 %) absolvovalo obojstrannú disekciu lymfatických uzlín minimálne v rozsahu VI. skupiny LU obojstranne (centrálny kompartment) (tab. 2).
Lobektómiu (ďalej len LTE) sme na našej klinike vykonali u 23 pacientov s PTC. U 11 z nich predoperačný nález nebol podozrivý z malignity (incidentálny nález), u 12 pacientov sa jednalo o falošne negatívnu peroperačnú biopsiu. U 19 pacientov z tejto skupiny bola vykonaná kompletizácia tyreoidektómie (totálna tyreoidektómia po predchádzajúcej lobektómii), z toho u 5 doplnená o unilaterálnu a u 7 pacientov o bilaterálnu disekciu krčných LU. Kompletizáciu odmietli 4 pacienti. TTE teda podstúpilo 332 pacientov s PTC, čo je 98,8 %.
Predoperačný N status
Počet pacientov prijatých s N0/Nx statusom bol 324. Pacientov prijatých s N1 statusom bolo 12, z nich 10 boli vo veku nad 45 rokov. U 11 sa jednalo o reoperáciu a boli prijatí za účelom revízie a disekcie krčných LU, u 1 pacienta sa jednalo o náhodný histologický nález MTS PTC v krčnej LU a následne bol prijatý k TTE a disekcii krčných LU. U 4 pacientov prijatých s N1 statusom bolo zároveň prítomné aj multifokálne postihnutie.
Reoperácie
Počet pacientov, u ktorých sme vykonali reoperáciu, bol 52. Ak nami operovaný pacient vyžadoval reoperáciu, táto bola vykonaná opätovne na našej klinike. Indikácie k reoperácii boli nasledovné: a) kompletizácia výkonu po lobektómii (prípadne kompletizácia s disekciou krčných LU), b) odstránenie rezidua PTC v lôžku po tyreoidektómii, c) disekcia krčných LU pre susp. MTS, d) záchranná operácia pre komplikáciu onkologického ochorenia. Kompletizáciu tyreoidektómie (po lobektómii) sme vykonali u 19 pacientov, PTC v druhom laloku bol potvrdený u 2 pacientov. Disekciu krčných LU v tejto skupine sme vykonali u 32 pacientov, metastázy PTC v LU boli potvrdené u 28 pacientov, v 4 prípadoch sme MTS histopatologicky nepotvrdili aj napriek klinickému podozreniu. Pre dusivý stav v dôsledku útlaku spôsobeného tumoróznou masou bola reoperácia vykonaná u 1 pacienta.
VÝSLEDKY
Vekové a pohlavné zastúpenie pacientov
Vek 336 pacientov postihnutých PTC sa pohyboval v rozmedzí od 13 do 81 rokov. Počty pacientov pre každé decénium sú uvedené v tabuľke 3. Najčastejšie postihnutou skupinou v našom súbore sú pacienti v 6. (32, %), 5. (19,6 %) a 4. (17 %) decéniu. Pacientov mladších ako 45 rokov bolo 135 (40,2 %), pacientov starších ako 45 rokov bolo 201 (59,8 %). V súbore prevažujú ženy v pomere k mužom 3,4: 1.

Veľkosť primárneho tumoru
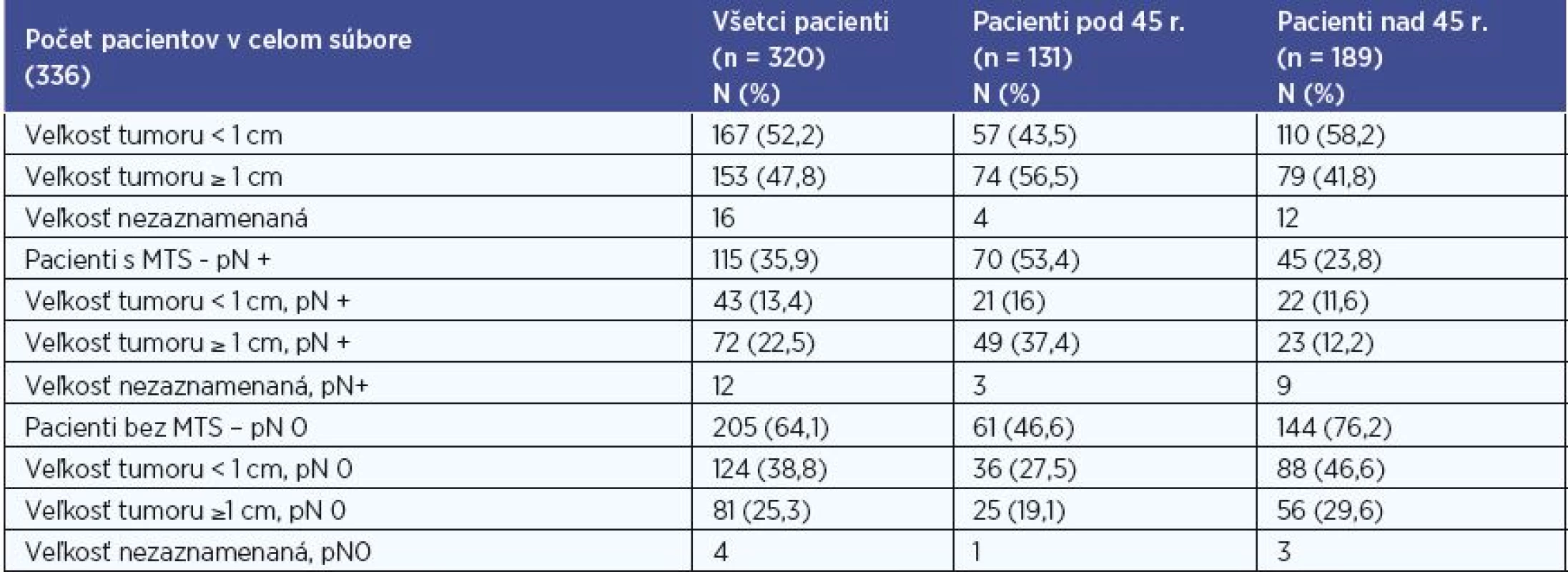
V súbore sme hodnotili veľkosť tumoru < 1cm a ≥ 1cm na základe histologického výsledku. Hodnotenie sme realizovali pre súbor všetkých pacientov, pre skupinu pacientov do 45 rokov, pre skupinu pacientov nad 45 rokov, a to aj vo vzťahu k metastatickému postihnutiu (tab. 4). Údaje o veľkosti sme mali k dispozícii u 320 (95 %) pacientov. Z nich 167 pacientov (52,2 %) malo tumor < 1 cm, u 153 pacientov (47,8 %) bol tumor ≥ 1 cm . V skupine do 45 rokov bol tumor < 1 cm u 57 pacientov (43,5 %), tumor ≥ 1 cm u 74 (56,5 %) . V skupine nad 45 rokov bol pomer 110 (58,2 %) < 1 cm versus 79 (41,8 %) ≥ 1 cm. Najmenší zachytený mikrokarcinóm mal veľkosť 0,84 mm. Najčastejšie sa vyskytoval rozmer tumoru medzi 5-9,9 mm (30,6 %), 10-14,9 mm (24,7 %) a 2-4,9 mm (16,9 %).
Pri štatistickom vyhodnocovaní sme na hladine signifikancie 0,01 a 0,001 zaznamenali u pacientov bez MTS postihnutia častejšie veľkosť tumoru <1 cm a u pacientov s MTS postihnutím častejšie veľkosť tumoru ≥1 cm v súbore všetkých pacientov, P < 0,001 (P = 0,00011) a v skupine pacientov pod 45 rokov, P < 0,01 (P = 0,0015). V skupine pacientov nad 45 rokov sme nezaznamenali u pacientov s MTS postihnutím signifikantne častejšie veľkosť tumoru ≥1 cm (P = 0,201).
Infiltrácia puzdra štítnej žľazy
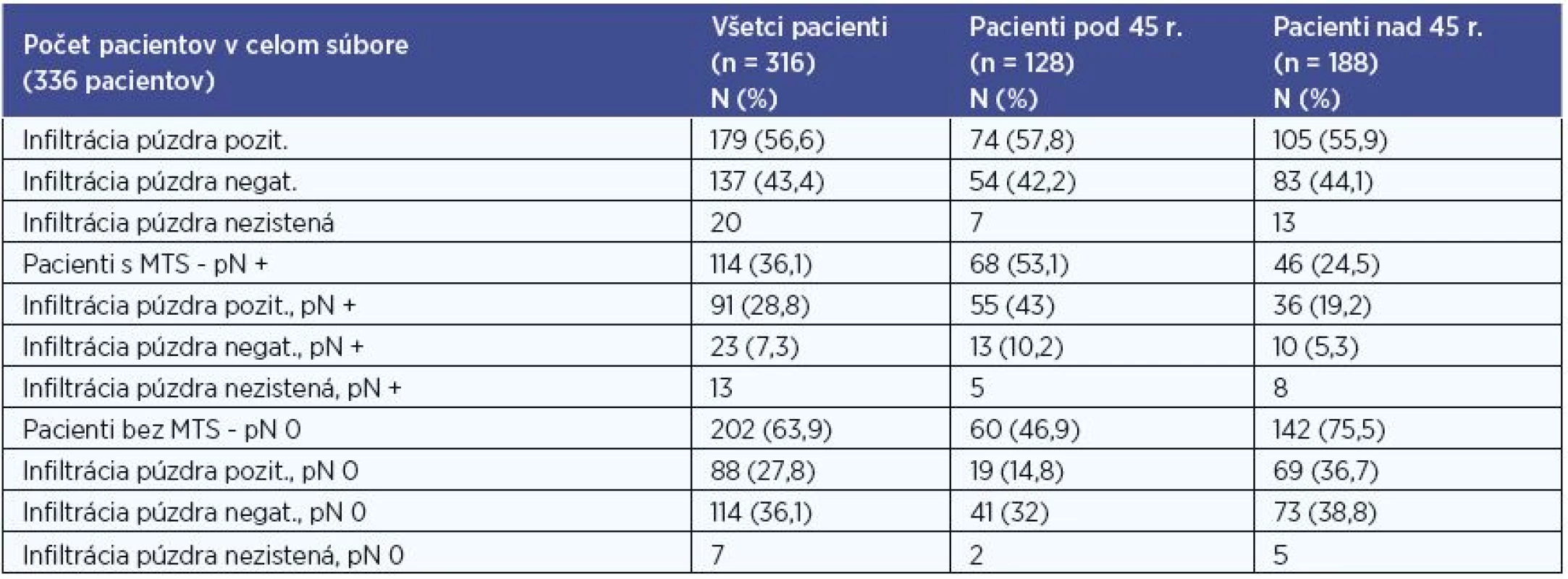
V súbore sme na základe histologického výsledku hodnotili prítomnosť infiltrácie puzdra štítnej žľazy karcinómom. Hodnotenie sme realizovali pre súbor všetkých pacientov, pre skupinu pacientov do 45 rokov, pre skupinu pacientov nad 45 rokov, a to aj vo vzťahu k metastatickému postihnutiu (tab. 5). Údaje o infiltrácii sme mali k dispozícii u 316 (94 %) pacientov.
Pri štatistickom vyhodnocovaní sme na hladine signifikancie 0,001 zaznamenali u pacientov bez MTS postihnutia častejšie negatívnu infiltráciu puzdra štítnej žľazy a v skupine pacientov s MTS postihnutím častejšie pozitívnu infiltrácia puzdra štítnej žľazy v súbore všetkých pacientov, P < 0,001 (P = 0,0000001), v skupine pacientov pod 45 rokov, P < 0,001 (P = 0,0000001) aj v skupine pacientov nad 45 rokov, P < 0.001 (P = 0,0008).
Lymfangioinvázia
V súbore sme hodnotili na základe histologického výsledku hodnotili prítomnosť lymfangioinvázie karcinómom. Hodnotenie sme realizovali pre súbor všetkých pacientov, pre skupinu pacientov do 45 rokov, pre skupinu pacientov nad 45 rokov, a to aj vo vzťahu k metastatickému postihnutiu (tab. 6). Údaje o lymfangioinvázii sme mali k dispozícii u 305 (90,8 %) pacientov.
Pri štatistickom vyhodnocovaní sme na hladinách signifikancie 0,01 a 0,001 zaznamenali u pacientov bez MTS postihnutia častejšie negatívnu lymfangioinváziu a u pacientov s MTS postihnutím častejšie pozitívnu lymfangioinváziu v súbore všetkých pacientov, P < 0,001 (P = 0,0000056) a v skupine pacientov pod 45 rokov, P < 0,01 (P = 0,0063).

Metastatické postihnutie regionálnych krčných LU
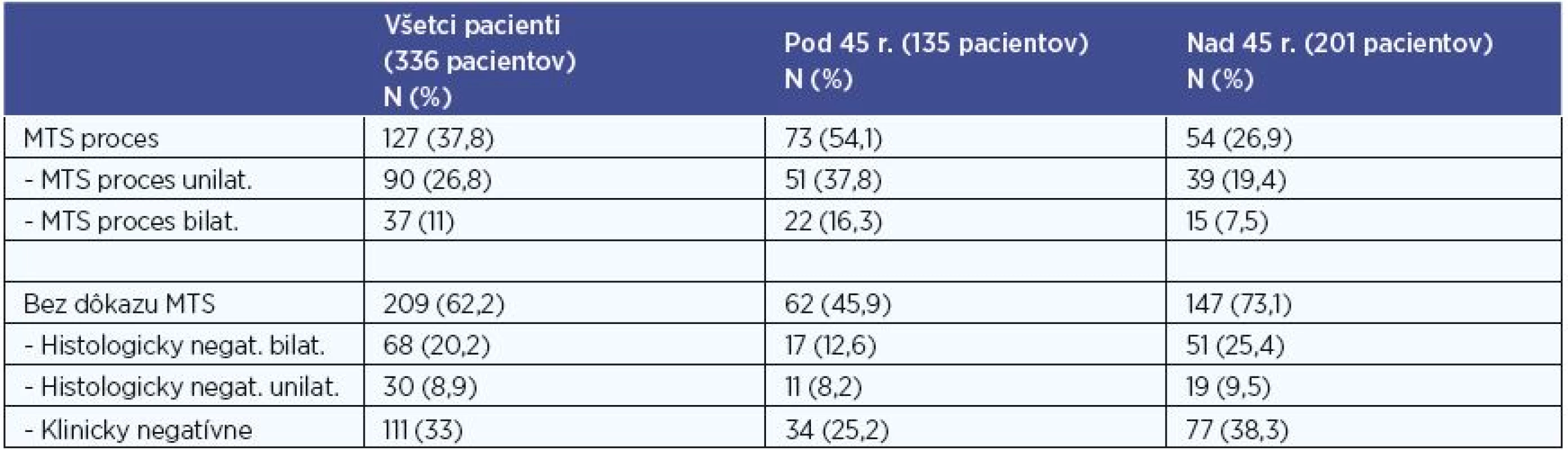
V súbore všetkých 336 pacientov postihnutých PTC boli definitívnou histológiou verifikované MTS do regionálnych LU u 127 (37,8 %) pacientov. Unilaterálne postihnutie sme potvrdili u 90 pacientov (26,8 %) (z toho kontralaterálne v 4 prípadoch) a bilaterálne u 37 (11 %) pacientov (tab. 7).
Negatívny nález MTS v regionálnych LU bol u 209 (62,2 %) pacientov. U 111 z nich (33 %) bol N0 status (presnejšie pNx) stanovený klinickým vyšetrením a zobrazovacími technikami (bez histologickej verifikácie). U 98 pacientov (29,1 %) pacientov bol potvrdený N0 status negatívnym histologickým nálezom, z nich u 68 (20,2 %) v bilaterálnom disekáte regionálnych krčných LU (v minimálnom rozsahu disekcie centrálneho kompartmentu bilaterálne), u 30 (8,9 %) bol negatívny histologický nález po unilaterálnej disekcii (v minimálnom rozsahu disekcie centrálneho kompartmentu unilaterálne), pričom na strane kontralaterálnej bolo MTS postihnutie vylúčené klinickým vyšetrením a zobrazovacími technikami (tab. 7).
Pri porovnaní skupiny pacientov do 45 rokov a skupiny pacientov nad 45 rokov sme MTS postihnutie regionálnych LU diagnostikovali v 54,1 % vs. 26,9 % pacientov. V skupine pacientov s PTC mladších ako 45 rokov sme na hladine štatistickej signifikancie 0,001 zaznamenali vyšší výskyt metastatického postihnutia regionálnych krčných lymfatických uzlín v porovnaní s pacientmi nad 45 rokov, P < 0,001 (P=0,000072). Unilaterálne MTS sme diagnostikovali v 37,8 % vs. 19,4 % a bilaterálne MTS v 16,3 % vs. 7,5 % pacientov (tab. 7).
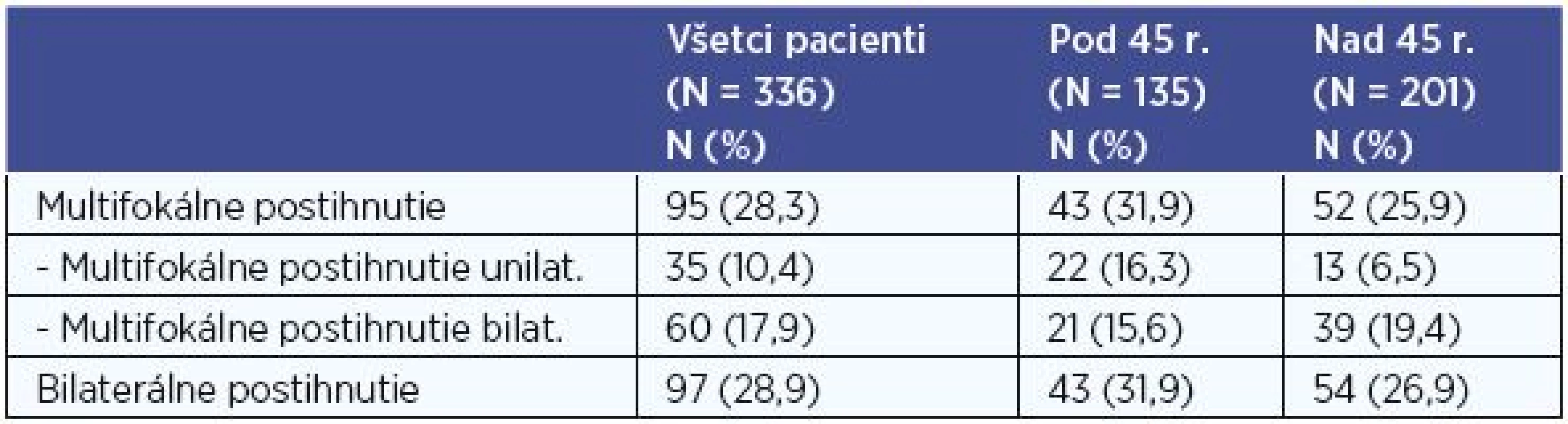
Multifokálne a bilaterálne postihnutie
V súbore všetkých 336 pacientov s PTC sme vyhodnotili histologicky verifikovaný multifokálny výskyt karcinómu. Viac ako jedno ložisko PTC v lalokoch štítnej žľazy sme diagnostikovali u 95 (28,3 %) pacientov, z nich bolo 43 pacientov mladších ako 45 rokov, starších ako 45 rokov bolo 52. Unilaterálne multifokálne postihnutie sme zaznamenali u 35 (10,4 %) a bilaterálne u 60 (17,9 %) pacientov (tab. 8).
Pri porovnaní skupiny pacientov do 45 rokov a skupiny pacientov nad 45 rokov sme multifokálne postihnutie diagnostikovali v 31,9 % vs. 25,9 % pacientov, P < 0,05 (P = 0,025). Preukázali sme štatisticky signifikantne vyšší výskyt multifokálneho postihnutia u pacientov vo veku do 45 rokov. Unilaterálne multifokálne postihnutie sme diagnostikovali v 16,3 % vs. 6,5 % a bilaterálne postihnutie v 15,6 % vs. 19,5 % pacientov (tab. 8).
Bilaterálne postihnutie (bilaterálne MTS postihnutie a/alebo bilaterálne multifokálne postihnutie) v celom súbore sme diagnostikovali u 97 (28,9 %) pacientov (tab. 8), a to bez zjavnej závislosti k vekovej hranici 45 rokov (P = 0,386).
DISKUSIA
Celková mortalita sa u pacientov s PTC pohybuje medzi 1,2 až 17 %, priemerné desaťročné prežívanie sa pohybuje v rozmedzí 85 až 99 % (20) a klesá pri narastajúcej veľkosti tumoru a extratyroidálnom šírení (3). Päťročné prežívanie u PTC obmedzeného na tkanivo štítnej žľazy je 99,7 %, v prípade MTS do krčných LU 96,9 % a pri vzdialených MTS 57,8 % (25). Je však otázne, nakoľko relevantné je 5-10-ročné prežívanie pri charaktere PTC, ak sa zároveň neposudzuje kvalita života a celkové prežívanie po dlhšej dobe. Niektorí autori poukazujú na významne vyššie riziko uzlinových recidív a často aj horšiu prognózu u pacientov s krčnými MTS, kedy zaznamenali zvýšenie rizika úmrtia o 46 % (25, 26). Prítomnosť metastáz teda významne znižuje celkové prežívanie. Literárne údaje o MTS postihnutí regionálnych krčných LU sú rôzne (20-80 % pacientov), a to aj pri malých intratyroidálnych tumoroch. V našej skupine pacientov do 45 rokov to bolo 54,1 %. Najčastejšie býva postihnutý centrálny kompartment (oblasť VI), pričom mikrometastázy sa vyskytujú s frekvenciou dosahujúcou až 90 % v závislosti od senzitivity detekčnej metódy (6, 20, 22, 25). Laterálny kompartment býva postihnutý zriedkavejšie (typicky v oblasti III a IV, výnimočne oblasti II a V), (10, 11).
S prítomnosťou lokoregionálneho MTS postihnutia, veľkosťou primárneho tumoru, extrakapsulárnym šírením a vzdialenými metastázami významne súvisí miera perzistencie a rekurencie PTC ovplyvňujúca ďalší osud pacienta, počet chirurgických výkonov, rozsah a dĺžku onkologickej liečby rádiojódom alebo externým žiarením (14, 16). Perzistencia a rekurencia ochorenia zhoršujú kvalitu života pacienta a znižujú medián prežívania nezávisle od veku pacienta (6, 14, 17). Veľkosť tumoru ≥1 cm u 56,5 % , pozitívna infiltrácia puzdra štítnej žľazy u 57,8 %, pozitívna lymfangioinvázia u 20,5 % a frekvencia metastázovania PTC do krčných LU na úrovni 54,1 % u pacientov do 45 rokov v našom súbore je podnetom na zamyslenie sa nad TNM stagingom, ktorý u tejto vekovej skupiny nerešpektuje fakt, že prítomnosť týchto rizikových faktorov ovplyvňuje medián prežívania, mieru perzistencie a rekurencie choroby, teda prognózu a kvalitu ďalšieho života.
Vzhľadom k dlhodobému prežívaniu je hodnotenie prínosu jednotlivých liečebných algoritmov a chirurgických postupov obtiažne a časovo veľmi náročné. Názory na rozsah chirurgickej liečby PTC sú kontroverzné, a to predovšetkým ohľadom prínosu elektívnej disekcie centrálneho kompartmentu (1, 7). Fakt, že pacienti majú porovnateľné 10 a viac ročné prežívanie bez ohľadu na rozsah chirurgickej liečby vysvetľuje tendenciu presadzovať limitované chirurgické výkony (LTE) a odmietať radikalitu výkonu v zmysle TTE a elektívnej disekcie centrálneho kompartmentu (2, 3, 19, 21, 24). Výskyt regionálnych metastáz na úrovni 37,8 % v celom súbore a až 54,1 % v skupine pacientov do 45 rokov nás však núti sa zamyslieť nad možnosťou štandardného vykonávania TTE a elektívnej disekcie centrálneho kompartmentu u pacientov s histologicky verifikovaným PTC (pozitívna peroperačná alebo pozitívna definitívna histológia). Pri posudzovaní kvality života pacienta treba totiž zohľadniť či napríklad 30-40-ročný pacient 20 rokov po stanovení diagnózy prežíva bez recidívy, generalizácie a nutnosti opakovaných terapeutických zásahov, alebo naopak dlhodobo opakovane absolvuje množstvo liečebných chirurgických a rádioterapeutických procedúr pre výskyt regionálnych alebo vzdialených MTS.
Pri rozhodovaní sa o rozsahu chirurgického výkonu treba mať na pamäti, že správna chirurgická intervencia je doposiaľ najdôležitejšia forma liečby (6). Liečba rádiojódom, TSH supresia a externá rádioterapia hrajú adjuvantnú úlohu (6). Dostatočná iniciálna liečba a následné sledovanie môže poskytnúť takmer u 90 % pacientov permanentný stav bez ochorenia, má dlhodobé následky na rekurenciu a prežívanie (9, 18), redukuje riziko reoperácie, a teda aj trvalé komplikácie, ktoré môžu byť po revíznom výkone dvojnásobne vyššie ako po primárnom výkone (3, 9). Pri dodržaní štandardných postupov v priebehu operácie a v pooperačnom období je percento komplikácií nízke i pri rozsiahlejších výkonoch (3, 5, 8). LTE nie je niektorými autormi považovaná za dostatočne radikálny výkon, nakoľko je spojená s vyšším rizikom lokálnej recidívy, rekurencie, rozvojom malignity v kontralaterálnom laloku v prípade multifokálneho výskytu. Toto riziko je výraznejšie pri tumoroch ≥1 cm, nezávisle od veku (3, 6, 12, 13, 18). LTE neumožňuje adjuvantnú onkologickú liečbu ani monitoring (využitie telového skenu a možnosť merania hladiny Tg v sére) (6) a zároveň zvyšuje riziko komplikácií spojené s prípadným revíznym zákrokom a hrozí rozvojom malignity v kontralaterálnom laloku v prípade multifokálneho výskytu (6). Nejde nám o presadzovanie konkrétnych postupov a názorov, skôr o impulz k ich analýze a prehodnoteniu so zvýšeným dôrazom na mladšieho pacienta, nakoľko vek nepovažujeme u tohto ochorenia za špecifický rizikový faktor a jeho využitie v podobe nezávislého faktora v liečebnom algoritme považujeme za sporné.
Neoddeliteľnou súčasťou chirurgickej liečby je perioperačný manažment. Predoperačne zrealizovaná ultrasonografia (ďalej len USG), diagnostická tenkoihlová aspiračná biopsia (ďalej len FNAB), ak je vykonaná správne, dokáže výrazne usmerniť prvotné rozhodovanie sa o rozsahu chirurgického výkonu. Následne kroky operatéra usmerní peroperačná biopsia, ktorá môže ovplyvniť radikalitu výkonu. Predoperačné USG identifikuje suspektné MTS v regionálnych krčných LU v 20-31 % prípadov, identifikuje zhruba polovicu LU nájdených počas operácie, a to z dôvodu ich prekrytia tkanivom štítnej žľazy (6, 23). Pomocou FNAB by mali byť vyšetrené všetky uzly ≥10 mm a každý dostupný klinicky podozrivý uzol bez ohľadu na jeho veľkosť (6). Senzitivita FNAB na špičkových pracoviskách dosahuje až 98,9 % (15). Tieto vyšetrenia sú dôležitou súčasťou chirurgie štítnej žľazy, a to obzvlášť u onkologických pacientov.
ZÁVER
Spomedzi onkologických ochorení štítnej žľazy sa najčastejšie stretávame s PTC. Aj napriek tomu, že sa jedná o diferencovaný karcinóm s dobrou prognózou prežívania, je preň typický vysoký výskyt okultných metastáz, ktorý sme zaznamenali aj v našom súbore. Taktiež sme zaznamenali štatisticky signifikantne častejší stav s metastatický postihnutím u pacientov s primárnym tumorom ≥ 1 cm, pozitívnou infiltráciou puzdra štítnej žľazy a pozitívnou lymfangioinváziou. Najefektívnejšou liečebnou modalitou je chirurgická liečba. Jej cieľom je eradikovať ochorenie primooperáciou, znížiť počet incidentálnych nálezov, počet reoperácií, zabrániť perzistencii a rekurencii ochorenia, znížiť nutnosť využitia adjuvantnej onkologickej liečby. Podmienkou úspešnosti chirurgickej liečby je správny perioperačný manažment a dostatočná radikalita chirurgického výkonu.
Adresa ke korespondenci:
MUDr. Marián Sičák, PhD
Klinika ORL chirurgie hlavy a krku FN
Ústredná vojenská nemocnica
Ul. gen. M. Vesela 21
034 00 Ružomberok
Slovenská republika
e-mail: sicakm@uvn.sk
Sources
1. Astl, J., Čelakovský, P.: Nádory štítné žlázy. In Čelakovský, P., Plzák, J., Betka J. a kol.: Krční metastázy. Tobiáš, 2012, s. 232-238.
2. Betka, J., Mrzena, L., Astl, J. et al.: Surgical treatment strategy for thyroid gland carcinoma nodal metastases. Eur. Arch. Otorhinolaryngol., 254 (Suppl. 1), 1997, s. 169-174. 3. Bilimoria, K. Y., Bentrem, D. J., Ko, C. Y. et al.: Extent of surgery affects survival for papillary thyroid cancer. Ann. Surg., 246, 2007, s. 375-381.
4. Brierley, J. D., Panzarella, T., Tsang, R. W. et al.: A comparison of different staging systems predictability of patient outcome. Thyroid carcinoma as an example. Cancer, 79, 1997, s. 2414-2423.
5. Carling, T., Carty, S. E., Ciarleglio, M. M. et al.: American thyroid association design and feasibility of a prospective randomized controlled trial of prophylactic central lymph node dissection for papillary thyroid carcinoma. Thyroid, 22, 2012, s. 237-244.
6. Cooper, D. S., Doherty, G. M., Haugen, B. R. et al.: Revised american thyroid association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid, 19, 2009, s. 1167-1199.
7. Čelakovský, P., Plzák, J., Kalfeřt, D. et al.: Krční disekce u papilárního karcinomu štítné žlázy. Otorinolaryng. a Foniat. /Prague/, 64, 2015, 2, s. 93-97.
8. Ďurík, S., Sičák, M., Obtulovič, M. et al.: Identifikácia a monitoring návratného nervu pri revíznych operáciách štítnej žľazy. Otorinolaryng. a Foniat. /Prague/, 58, 2009; 3, s. 166.
9. Esnaola, N. F., Cantor, S. B., Sherman, S. I. et al.: Optimal treatment strategy in patients with papillary thyroid cancer: a decision analysis. Surgery, 130, 2001, s. 921-930.
10. Grimm, O., Rath, F. W., Dralle, H.: Pattern of lymph node metastases in papillary thyroid carcinoma. Brit. J. Surg., 85, 1998, s. 252-254.
11. Hartl, D. M., Mamelle, E., Borget, I. et al.: Influence of prophylactic neck dissection on rate of retreatment for papillary thyroid carcinoma. World J. Surg., 37, 2013, s. 1951-1958.
12. Hay, I. D., Grant, C. S., Bergstralh, E. J. et al.: Unilateral total lobectomy: is it sufficient surgical treatment for patients with AMES low-risk papillary thyroid carcinoma? Surgery, 124, 1998, s. 958-964.
13. Hay, I. D., Thompson, G. B., Grant, C. S. et al.: Papillary thyroid carcinoma managed at the Mayo Clinic during six decades (1940–1999): temporal trends in initial therapy and long-term outcome in 2444 consecutively treated patients. World J. Surg., 26, 2002, s. 879-885.
14. Chow, S. M., Law S. C., Chan, J. K. et al.: Papillary microcarcinoma of the thyroid-Prognostic significance of lymph node metastasis and multifocality. Cancer, 98, 2003, s. 31-40.
15. Ito, Y., Uruno, T., Nakano, K. et al.: An observation trial without surgical treatment in patients with papillary microcarcinoma of the thyroid. Thyroid, 13, 2003, s. 381-387.
16. Lebolleux, S., Rubino, C., Baudin, E. et al.: Prognostic factors for persistent or recurrent disease of papillary thyroid carcinoma with neck lymph node metastases and or tumor extension beyond the thyroid capsule at initial diagnosis. J. Clin. Endocrinol. Metab., 90, 2005, s. 5723-5729.
17. Links, T. P., van Tol, K. M., Jager, P. L. et al.: Life expectancy in differentiated thyroid cancer: a novel approach to survival analysis. Endocr. Relat. Cancer, 12, 2005, s. 273-280.
18. Mazzaferri, E. L.: An overview of the management of papillary and follicular thyroid carcinoma. Thyroid, 9, 1999, s. 421-427.
19. Pacini, F., Schlumberger, M., Dralle H. et al.: European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium. Eur. J. Endocrinol., 154, 2006, s. 787-803.
20. Patron, V., Hitier, M., Bedfert, C. et al.: Predictive factors for lateral occult lymph node metastasis in papillary thyroid carcinoma. Eur. Arch. Otorhinolaryngol., 270, 2013; s. 2095-2100.
21. Pitoia, F., Ward, L., Wohllk, N. et al.: Recommendations of the Latin American Thyroid Society on diagnosis and management of differentiated thyroid cancer. Arq. Bras. Endocrinol. Metabol., 53, 2009, s. 884-887.
22. Qubain, S. W., Nakano, S., Baba, M. et al.: Distribution of lymph node micrometastasis in pN0 well-differentiated thyroid carcinoma. Surgery, 131, 2002, s. 249-256.
23. Sojak, J., Sičák, M., Obtulovičová, K. et al.: Papilárny karcinóm štítnej žľazy: perioperačný manažment chirurgickej liečby. Interná med., 13, 2013; s. 451-455.
24. Takami, H., Ito, Y., Okamoto, T. et al.: Therapeutic strategy for differentiated thyroid carcinoma in Japan based on a newly established guideline managed by Japanese Society of Thyroid Surgeons and Japanese Association of Endocrine Surgeons. World J. Surg., 35, 2011, s. 111-121.
25. Teixeira, G., Teixeira, T., Gubert, F. et al.: The incidence of central neck micrometastasis disease in patients with papillary thyroid cancer staged preoperatively and intraoperatively as N0. Surgery, 150, 2011, s. 1161-1167.
26. Zaydfudim, V., Feurer, I. D., Griffin, M. R. et al.: The impact of lymph node involvement on survival in patients with papillary and folicular thyroid carcinoma. Surgery, 144, 2008, s. 1070-1078.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)Article was published in
Otorhinolaryngology and Phoniatrics

2016 Issue 4
Most read in this issue
- Antromastoidektomie v dětském věku
- Papilárny karcinóm štítnej žľazy: Analýza veľkosti primárneho tumoru, infiltrácie puzdra štítnej žľazy a lymfangioinvázie vzhľadom k lokoregionálnemu metastázovaniu a veku
- Chirurgická léčba Ménièrovy nemoci: Naše zkušenosti s dekompresí endolymfatického vaku
- Presbyakuze
