Doporučené postupy v diagnostice a léčbě nádorů příušní žlázy
Guidelines for Diagnosis and Treatment of Parotid Gland Tumours
The members of the Salivary Section of the Czech Society of Otorhinolaryngology and Head and Neck Surgery present up-to-date guidelines for diagnosis and treatment of parotid gland tumours.
Keywords:
parotid gland, salivary gland, guidelines
Authors:
I. Stárek 1; Richard Salzman 1
; A. Skálová 2; M. Chovanec 3
; P. Gál 4; M. Zábrodský 5; L. Školoudík 6; J. Rotnágl 7
; I. Pár 8; P. Štrympl 9
Authors‘ workplace:
Klinika otolaryngologie LF UP a FN Olomouc
1; Šiklův patologicko-anatomický ústav Plzeň
2; ORl FN 3. LF UK a FNKV, Praha
3; Klinika otorinolaryngologie a chirurgie hlavy a krku FN U svaté Anny a LF MU Brno
4; Klinika ORL a chirurgie hlavy a krku1. LF UK a FN v Motole, Praha
5; Klinika otorinolaryngologie a chirurgie hlavy a krku LF UK a FN Hradec Králové
6; Klinika otorhinolaryngologie a maxilofaciální chirurgie ÚVN Praha
7; ORL oddělení Kroměřížská nemocnice
8; Otorinolaryngologická klinika FN Ostrava
9
Published in:
Otorinolaryngol Foniatr, 66, 2017, No. 3, pp. 119-126.
Category:
Review Article
Overview
V článku členové Sekce slinných žláz České společnosti otorinolaryngologie a chirurgie hlavy a krku ČLS JEP prezentují diagnosticko-terapeutické doporučené postupy pro nádory příušní žlázy vycházející z aktuálních poznatků.
Klíčová slova:
slinné žlázy, doporučený postup
ÚVOD
Tumory slinných žláz jsou charakterizovány velkým počtem histopatologických jednotek se značně variabilním a individuálně velmi obtížně předvídatelným biologickým chováním. To může být příčinou nepřiměřeně rozsáhlých, na druhé straně pak nedostatečně radikálních chirurgických výkonů, vystavujících pacienta zbytečnému riziku trvalých pooperačních následků, resp. zhoršujících prognózu nemoci. Je tomu tak především pro převažující tumory příušní žlázy, v jejichž operativě je nutno respektovat zde probíhající lícní nerv.
Klinické i patologicko-anatomické problematice salivárních nádorů je v poslední době věnována velká pozornost. Výsledky tohoto bádání přinesly změny v diagnostických a terapeutických přístupech, optimalizujících léčebnou péči a její výsledky. V českém písemnictví však přehledné informace, týkající se uvedené problematiky, nebyly dosud publikovány. V roce 2016 byla při České společnosti pro otorinolaryngologii a chirurgii hlavy a krku ČLS JEP založena Sekce slinných žláz. Jejím prvním počinem je vypracování diagnosticko-terapeutického standardu tumorů příušní žlázy. V něm jsou zohledněny nejnovější poznatky z patobiologie nádorů slinných žláz, jakož i zkušenosti z velkých klinických pracovišť, z nichž se rekrutují zakládající členové této sekce. Náplní její práce je vedle praktických aspektů i výzkum salivárních nádorů, který díky molekulárně-genetickým metodám doznává v současnosti prudkého rozvoje a otevírá tak bránu novým možnostem léčby především prognosticky nejzávažnějších histopatologických jednotek. Respektování diagnosticko-terapeutických doporučených postupů je i podmínkou pro provádění multicentrických studií, vyžadujících potřebnou velikost a homogenitu zkoumaných souborů. Tyto požadavky by při vzácnosti některých typů salivárních tumorů nebyly hodnocením výsledků z jednoho nebo dvou pracovišť dosažitelné.
Epidemiologické a etiopatogenetické aspekty nádorů slinných žláz
Nádory slinných žláz jsou poměrně vzácná onemocnění, na všech tumorech hlavy a krku se podílejí ne více než 5 %. Největší, více než 80% predilekci jejich výskytu vykazuje gl. parotis. Na gl. submandibularis připadá necelých 20 % případů, zbylá část tumorů vychází z gl. sublingualis a malých slinných žláz. Obecně velikost žlázy má inverzní, dosud však neobjasněný vztah k relativnímu zastoupení z ní vycházejících karcinomů. Ty v gl. parotis představují jen asi 20 %, v gl. submandibularis 50 %, v gl. sublingualis více než 90 % všech neoplazmat.
Incidence parotického karcinomu dle údajů ÚZIS v posledních hodnocených 15 letech (2000-2014) se v celé populaci ČR pohybovala mezi 0,42 až 0,54/100 tisíc obyvatel, přičemž byla o něco vyšší u mužů nežli u žen (0,4 až 0,8 vs. 0,21 až 0,5). Úmrtnost dle stejného zdroje ve stejném období činila celkově 0,14 až 0,23, u mužů byla větší než u žen (0,2 až 0,45 vs. 0,08 až 0,2). Incidence ani mortalita této nádorové skupiny však nevykazuje dlouhodobě vzestupnou tendenci. Z téhož pramene pak vyplývá, že za stejný časový interval nebyl rozdíl mezi incidencí časných (I+II) a pozdních (III+IV) klinických stadií (0,13 až 0,30 vs. 0,10 až 0,25), tato se však lišila mortalitou (0,01 až 0,07 vs. 0,11 až 0,25). Dále je zřejmé, že incidence a mortalita stoupá s věkem, nejvyšší je u nemocných nad 65 let. Tyto údaje potvrzují výsledky klinických studií, podle kterých je tento parametr prognostickým činitelem (4, 10).
Etiologie salivárních nádorů není dosud přesně známa. Jednoznačně byl prokázán vliv ionizujícího záření. V některých geografických oblastech je karcinom gl. parotis dáván do kauzativního vztahu k infekci virem Epstein-Barrové. Tumorigenní vliv jiných látek, jako např. barev na vlasy, je spekulativní.
V současné době se pozornost zaměřuje na genetické alterace, zodpovědné za vznik některých histopatologických jednotek. Jde většinou o chromozomální translokace (tab. 1). Stanovení těchto genetických změn má u některých tumorů vedle diferenciálně-diagnostického i význam prognostický (např. u karcinomu mukoepidermoidního). V poslední době jsou relevantní geny testovány i jako možné cíle biologické terapie (např. u sekretorického karcinomu slinných žláz). Pro chybění validní studií dosud nepronikly poznatky z oblasti molekulární patologie do terapeutických schémat této nádorové skupiny.
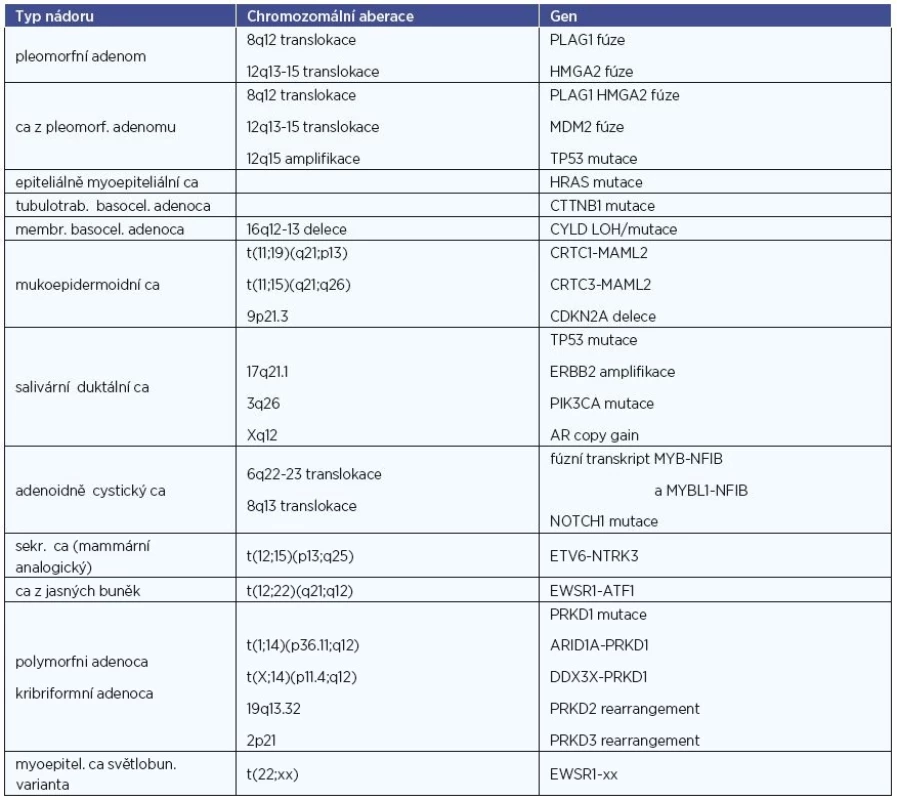
Klinicko-patologické aspekty nádorů slinných žláz (4, 5, 10, 28, 30)
Současná WHO klasifikace (r. 2017) definuje minimálně 11 benigních a 21 maligních sialomů s rozdílným biologickým chováním (tab. 2). V první skupině zcela převažuje (s cca 70 %) pleomorfní adenom, následovaný Warthinovým tumorem (20 %), ostatní jednotky (tj. monomorfní adenomy) jsou řídké. Biologické vlastnosti karcinomů jsou primárně určeny konkrétním histopatologickým typem, který je u mnoha z nich současně i implicitním vyjádřením stupně jejich malignity. Tak např. bazocelulární či acinocelulární karcinom jsou indolentní s tendencí k lokoregionálním recidivám, jejich sklon k uzlinovým a vzdáleným metastázám je však velmi malý. Oproti tomu salivární duktální karcinom vykazuje vysoce agresivní růst s vysokou incidencí lymfogenních metastáz již při nízkém klinickém stadiu. Většina typů karcinomů slinných žláz má tedy do jisté míry specifické biologické chování. Generální histopatologický grading (který je u většiny solidních non-salivárních malignit základním prognostickým faktorem) se tudíž u této onkologické skupiny jeví zbytečným a jeho použití není proto v současnosti doporučováno. Uplatňuje se jen u některých jednotek, konkrétně u karcinomu adenoidně cystického, mukoepidermoidního, intraduktálního a dále u adenokarcinomu jinak nespecifického (NOS). Odlišnosti v dignitě jednotlivých salivárních karcinomů odráží jejich rozdělení na léze s vysokým a nízkým biologickým rizikem (high a low-risk) (tab. 3).
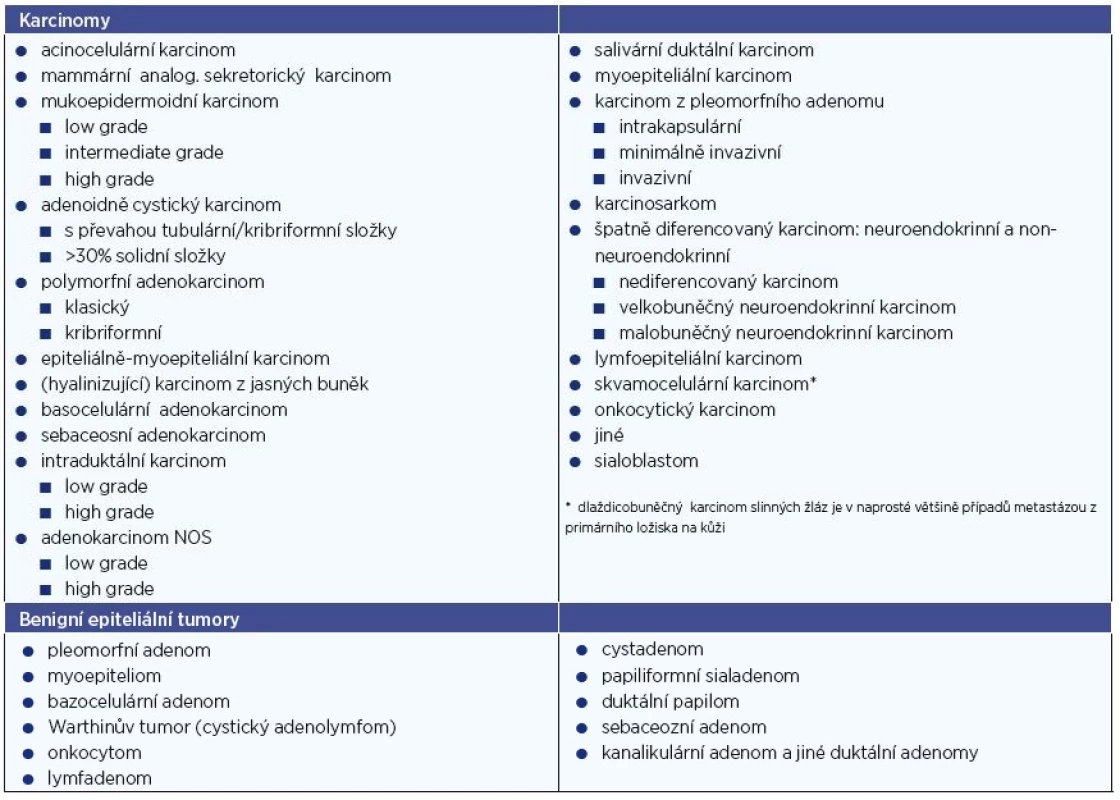
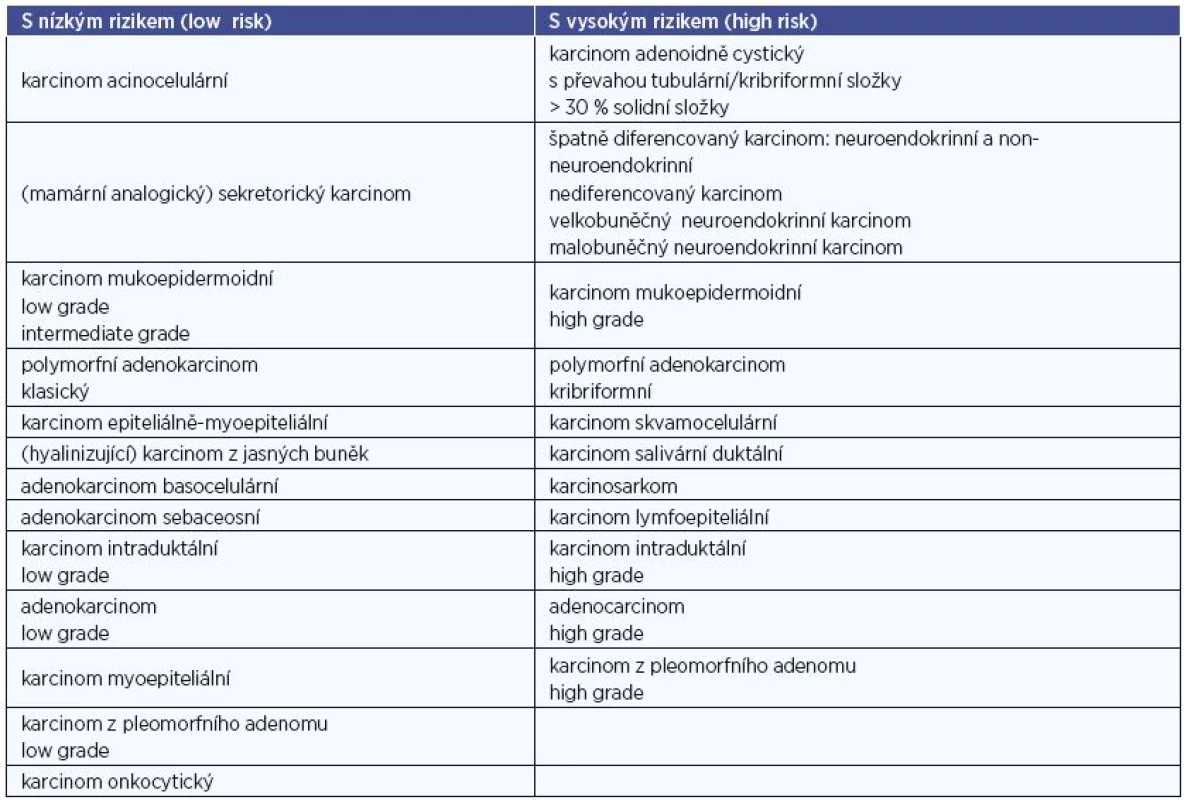
Vyšetřovací metody a postupy tumorů gl. Parotis
Cílem předoperačního vyšetření je potvrzení přítomnosti a stanovení klinického stadia nádorového onemocnění příušní žlázy.
Klinické vyšetření
Klinické vyšetření zahrnuje anamnézu a standardní fyzikální ORL vyšetření. Anamnesticky důležitý je údaj o rychlosti růstu tumoru, jíž se odlišují většinou pomalu progredující low- od agresivních high-risk karcinomů. Důležitá je informace o případných předcházejících maligních tumorech jiných primárních lokalit (především kůže ušního boltce a frontotemporální krajiny), neboť v pozitivním případě je nutno uvažovat o možném metastatickém postižení gl. parotis.
Při fyzikálním vyšetření se hodnotí velikost tumoru, jeho pohyblivost, známky šíření do okolních tkání, stav krčních uzlin a funkce lícního nervu. Klinický obraz je závislý především na histopatologické diagnóze, resp. biologickém riziku tumoru. Low-risk léze se nezřídka manifestují jako „benigní“ nebolestivé, volně nebo jen lehce omezeně pohyblivé rezistence. Postižení lícního nervu a krčních uzlin je vzácné. Rychle rostoucí high-risk karcinomy klinicky imponují jako objemné, fixované zduření, často se známkami infiltrace do kůže či okolních měkkých tkání a zevního zvukovodu. Obrna lícního nervu a metastatické postižení regionálních uzlin jsou přítomny asi u 20 % nemocných. Vzdálené metastázy nacházíme u primárních parotických karcinomů velmi vzácně.
Zobrazovací metody (7, 11, 13,15, 19, 20, 22, 29, 35)
Samotné klinické vyšetření nevykazuje dostatečnou spolehlivost v odlišení maligních od benigních tumorů, resp. jiných afekcí, proto jsou součástí předoperačního vyšetření zobrazovací metody. Z nich se v současnosti jako ekonomicky výhodná a relativně vysokou diagnostickou přesnost vykazující jeví ultrasonografie (US), doplněná výsledkem tenkojehlové aspirační cytologie (FNAC). Jejich kombinací lze salivární karcinomy detekovat až s 71% senzitivitou a téměř 100% specificitou. Takto je možno odlišit karcinomy od benigních adenomů (pleomorfní adenom, Warthinův tumor), cyst, reaktivních uzlinových afekcí, zánětlivých a jiných, nenádorových intraparenchymatózních procesů (např. sialadenóza, onkocytóza aj.).
Není-li zřejmý rozsah tumoru, vztah ke žláze a jejímu okolí, je indikováno MRI. Toto vyšetření se i přes časovou a finanční náročnost provádí nezřídka také jako primární zobrazovací metoda. Vedle obligatorních sekvencí T1 a T2 s potlačením tuku (STIR, FAT SAT) je možno použít i speciálních sekvencí, konkrétně DWI (diffusion weighted images), sloužící k identifikaci především pleomorfního adenomu a Warthinova tumoru, jež jsou díky svému vysokému relativnímu zastoupení nejdůležitější součástí diferenciální diagnózy parotických nádorů.
CT je vzhledem k nízkému kontrastu měkkých tkání indikováno především tam, kde nelze provést MRI a dále k ověření možného nádorového postižení mandibuly či kostních hranic pterygomandibulární jámy. PET/CT nemá významnou roli v odlišení benigních a maligních tumorů slinných žláz pro značné překrývání nálezů v těchto biologicky odlišných skupinách. Součástí všech zobrazovacích metod je posouzení krčních uzlin.
Vzhledem k velmi nízké incidenci vzdálených metastáz u primárních salivárních karcinomů není pátrání po nich součástí běžného diagnostického protokolu. PET/CT proto přichází v úvahu až v rámci follow-up při podezření na lokoregionální recidivu a/nebo generalizaci tumoru. Součástí klinického stagingu je i RTG snímek plic. Pravděpodobnost plicní diseminace primárních salivárních karcinomů je ve srovnání s ostatními malignitami hlavy a krku všeobecně nízká, stoupá však u high-risk lézí (především u karcinomu adenoidně cystického, mukoepidermoidního a salivárního duktálního), zejména pokud vycházejí z podčelistní žlázy.
Chirurgická léčba tumorů gl. parotis (1, 6, 8, 9,17, 18, 21, 24, 25, 32, 33, 34, 36, 38, 39).
Jedinou racionální léčbou nádorů slinných žláz je jejich operativní odstranění. Názory na chirurgii benigních parotických tumorů byly v minulosti značně odlišné, a jednoznačné shody v rozsahu parotidektomie nebylo dosaženo ani v době současné. U nejčastějšího typu, tedy pleomorfního adenomu, jevícího výrazný sklon k recidivám, je v závislosti na jeho velikosti a lokalizaci prováděna parciální, povrchová či totální parotidektomie. Filozofií těchto poměrně extenzivních postupů je vyloučení potenciálních nádorových reziduí, která se formou extrakapsulárních čepů šíří do okolního parenchymu žlázy. U zcela malých (do cca 1 cm) tumorů, uložených povrchově při zadním okraji žlázy, je v poslední době některými autory preferována extrakapsulární disekce. Při ní jsou potenciální, těsně za zevní hranicí pouzdra či okraje tumoru se nacházející ložiska likvidována elektrokoagulací. Dosavadní zkušenosti dokazují, že tento výkon, který na rozdíl od parotidektomie jakéhokoliv rozsahu není a priori spojen s disekcí n. facialis, nevykazuje vyšší procento recidiv, má však významně nižší incidenci výskytu dočasných i trvalých obrn tohoto nervu a dalších ranných i pozdních komplikací. Ze stejných důvodů je tato minimální chirurgie některými autory používána i u malých, klinicky jako benigní léze imponujících karcinomů (T1), vyrůstajících v téže parotické lokalizaci. Bylo prokázáno, že procento recidiv se významně neliší od nádorů stejného klinického stadia, které byly odstraněny radikálněji parotidektomií. Druhým nejčastějším benigním parotickým tumorem je Warthinův nádor (cystadenolymfom). V současné době se dříve odlišné názory na rozsah resekce příušní žlázy u této jednotky sjednotily v preferenci její pouhé exstirpace, k čemuž přispěla i skutečnost, že velká část Warthinových tumorů není pravým neoplazmatem, ale reaktivním pseudotumorem.
Pro salivární karcinomy je příznačná, nikoliv však absolutně platná korelace mezi stupněm malignity a klinickým stadiem. Léze nízkého biologického rizika tak valnou měrou diagnostikujeme v počátečních stadiích jejich růstu. Jsou převážně dobře ohraničené, vzácněji opouzdřené, a dosažení mikroskopicky negativních resekčních okrajů nečiní proto většinou potíží. Hlavním klinickým problémem těchto tumorů je skutečnost, že při fyzikálním vyšetření, jakož i na zobrazovacích metodách, imponují jako benigní adenomy. Neúplné odstranění, ke kterému tyto low-risk tumory mohou svádět, vede - mnohdy až za řadu let či desetiletí - k opakovaným recidivám, završeným exitem nemocného, např. u acinocelulárního a low-grade mukoepidermoidního karcinomu. Tyto původně biologicky příznivé léze mohou podlehnout tzv. high-grade transformaci, která dramaticky mění jejich chování, a tedy i terapeutický přístup. Uvedená vysoce prognosticky nepříznivá konverze může proběhnout rovněž u karcinomu adenoidně cystického. Ten je (s výjimkou vysoce agresivní formy, pozůstávající z více než 30 % ze solidních partií) charakterizován většinou pomalým, avšak nezadržitelným růstem s fatálním zakončením, pro které se řadí mezi high-risk léze.
Zcela jiná je situace u karcinomů vysokého biologického rizika. Pro značně agresivní růst jsou diagnostikovány většinou až v pokročilých klinických stadiích, kdy na široké frontě pronikají do okolních tkání, infiltrují cévy a nervy a v asi 20 % vykazují regionální metastázy.U salivárního duktálního karcinomu není vzácné, že výrazně infiltrativně roste již záhy po svém vzniku. Kompletní odstranění je z onkochirurgického hlediska proto možné jen u malé části nemocných. Ve většině případů nacházíme mikroskopickou pozitivitu resekčních okrajů. Prognóza je i přes radikální operační výkon na primárním ložisku i krčních uzlinách a adjuvantní radioterapii pochmurná.
Bloková disekce krčních uzlin je u karcinomů gl. parotis indikována vždy u pozitivního klinického nálezu (cN+), který nacházíme u 15 až 38 % takto postižených nemocných. Metastázy v lymfatických uzlinách, podobně jako u jiných (non-salivárních) karcinomů, redukují přežívání až o 50 %. Incidence uzlinových metastáz u salivárních karcinomů je závislá na klinickém stadiu tumoru a jeho histopatologickém typu (resp. biologickém riziku). U high-grade tumorů činí průměrně 49 %, u nejagresivnějších forem dosahuje až 60–80 % (např. high-grade mukoepidermoidní karcinom, nediferencovaný karcinom). U low-risk nádorů se výskyt uzlinových metastáz blíží nule, jen zřídka je v závislosti na histologické diagnóze udávána jejich až 20% incidence.
Uzlinové metastázy karcinomů příušní žlázy postihují především (v 74 %) úroveň II, ostatní úrovně asi v 15 – 20 % cN+ pacientů. Takto široký metastatický rozsev je indikací ke krční disekci v rozsahu I až V.
Incidence okultních metastáz parotických karcinomů kolísá ve značném rozmezí 12-50 %. Většina je lokalizována v oblasti II a III. Názory na indikace elektivních krčních disekcí u cN0 pacientů nejsou jednotné, většinou jsou však prováděny u karcinomu vysokého biologického rizika a pokročilého klinického stadia (T3, T4). Rovněž nepanuje shoda na rozsah elektivních blokových disekcí. Převážná část autorů je však provádí v oblasti II, III a Va.
Radioterapie a chemoterapie karcinomů slinných žláz (2, 12, 14, 16, 23, 26, 27, 31, 37)
Karcinomy slinných žláz patří mezi radiosenzitivní, nikoliv radiokurabilní tumory. Adjuvantní pooperační radioterapii indikujeme u karcinomů stadia T3, T4 a vysokého biologického rizika. U low-grade lézí a iniciálních klinických stadií (T1 a T2) je na místě při mikroskopické pozitivitě resekčních okrajů, invazi do lymfatických a/nebo krevních cév, perineurální infiltraci a při pN+. Klinickými studiemi byl prokázán příznivý vliv adjuvantní radioterapie na riziko vzniku lokoregionálních recidiv u salivárních karcinomů stadia T3, T4 a vysokého biologického rizika, kde dochází až k jejich 50% redukci. Význam ozáření pro celkové přežití však dosud nebyl jednoznačně prokázán v multivariační analýze.
Samotná radioterapie jako primární léčba je indikována u pacientů, u nichž je tumor z lokálních či celkových příčin inoperabilní. Její výsledky jsou však signifikantně horší než chirurgické odstranění samotné či jeho kombinace s následným ozářením.
Pacienti s karcinomy slinných žláz jsou po ukončení terapie dispenzarizováni. K recidivám dochází většinou (cca v 85 %) do 3 roků, takže doporučovaná délka sledovacího intervalu nepřesahuje 5 let. Tato doba, stejně jako frekvence kontrol, však může být v závislosti na biologické agresivitě tumoru individuálně upravena. U pleomorfního adenomu se díky jeho vysoké tendenci k recidivám, ke kterým může dojít až řadu desetiletí, doporučuje dlouholeté, až doživotní sledování pacienta. K dispenzarizaci monomorfních adenomů, které prakticky nerecidivují, není důvod. Podobně je tomu u často multiplicitně založeného Warthinova tumoru, kde ev. pozdní, až pacientem odhalené další ložisko neznamená žádné ohrožení jeho zdraví.
Chemoterapie má u karcinomů slinných žláz význam jen paliativní, je indikována u diseminovaných tumorů, kde může prodloužit život nemocného v řádu měsíců. Vzhledem k velkému počtu histotypů a chybění validních studií neexistují platné doporučené postupy. V monoterapii se nejčastěji užívá 5-fluorouracil, cisplatina a doxorubicin, v kombinačním léčebném schématu cyklofosfamid, doxorubicin a cisplatina. Částečná odpověď se dostavuje ve 22 až 100 %, kompletní až ve 40 %, efekt léčby je však jen krátkodobý. Značné rozpětí udávaných čísel je podmíněno odlišnou velikostí hodnocených souborů a různým zastoupením jednotlivých histopatologických jednotek. Názory na použití chemoterapie u jinak neléčitelných lokoregionálních recidiv jsou převážně zamítavé, neboť zde působí prakticky jen ve smyslu „ut aliquid fieri videatur“.
Pro neuspokojivé výsledky byť i komplexní léčby u karcinomů vysokého stupně biologického rizika a klinického stadia se v současné době stále více pozornosti věnuje identifikaci jejich prediktivních a prognostických molekulárních markerů s potenciálním využitím k cílené biologické léčbě. Tak u salivárního duktálního karcinomu byl prokázán 100% výskyt androgenních receptorů a ve 20 až 30 % exprese a amplifikace genu HER2/neu. Malý počet klinických studií však dosud brání zavedení jejich blokády do terapeutických standardů. Aktuálně probíhají klinické zkoušky Entrectinibu (inhibitor tyrozinkinázy) u sekrečního karcinomu slinných žláz, výsledky však nejsou zatím k dispozici.
Navržený diagnosticko-terapeutický algoritmus nádorů gl. parotis (schéma 1) vychází vedle vlastních zkušeností jeho autorů i z recentních poznatků, podložených řadou relevantních publikací. Problematika salivárních nádorů je ve všech jejích aspektech předmětem intenzivního výzkumu. Je tudíž zřejmé, že námi vypracované schéma dozná v nedaleké budoucnosti změn, reflektujících jeho výsledky.

Uvedený diagram nelze chápat jako přísné dogma. To ostatně platí pro všechny medicínské obory, zejména pak pro tumory příušní žlázy, unikátní velkou patomorfologickou, biologickou pestrostí, jakož i vztahem k lícnímu nervu. Ev. odchylný přístup však musí být podložen znalostí problematiky této nádorové skupiny. V opačném případě může dojít k poškození pacienta, které je v této oblasti velmi těžko napravitelné.
ZÁVĚR
Přehledový článek shrnuje nejnovější poznatky v diagnostice a léčbě nádorů příušních žláz, odrážející aktuální WHO klasifikaci a znalosti jejich molekulární genetiky. Dále navrhuje postupy v těch oblastech, kde není dosaženo všeobecného konsenzu.
Poděkování
Práce byla podpořena prostředky Institucionální podpory DRO (FNOl, 00098892), a Interního grantu Univerzity Palackého IGA LF 2017-004.
Adresa ke korespondenci:
MUDr. Richard Salzman, Ph.D.
Klinika otolaryngologie LF UP a FN
I. P. Pavlova 6
775 20 Olomouc
e-mail: richard.salzman@fnol.cz
Sources
1. Armstrong, J. G., Harrison, L. B., Thaler, H. T. et al.: The indications for elective treatment of the neck in cancer of the major salivary glands. Cancer, 69, 1992, s. 615-619.
2. Armstrong, J. G.: Malignant tumors of major salivary gland origin. A matched-paired surgery and postoperative radiotherapy. Arch. Otolaryng. Head Neck Surg., 116, 1990, s. 290-293.
3. Barnes, L., Eveson, J. W., Reichart, P. et al.: (eds).: WHO classification of tumours. Pathology and Genetics of Head and Neck Tumours. IARC Press, Lyon, 2005.
4. Bhattacharya, N., Fried, M. P.: Determinants of survival in parotid gland carcinoma: a population-based study. Am. J. Otolaryngol. 26, 2005, 1, s. 39-44.
5. Borthne, A.: Salivary gland malignant neoplasms: treatment and prognosis. Int. J. Radiat. Oncol. Biol. Physiol., 12, 1986, s. 747-751.
6. Califano, L., Zupi, A., Massari, P. S. et al.: Indication for neck dissection in carcinoma of the parotid gland. Our experience on 39 cases. Int. Surg., 78, 1993, s. 347-349.
7. De Ru, J. A., van Leeuwen, M. S., van Benthem, P. P. et al.: Do magnetic resonance imaging and ultrasound add anything to the preoperative workup of parotid gland tumors? J. Oral Maxillofac. Surg., 65, 2007, 5, s. 945-952.
8. Ferlito, A., Pellitteri, P. K., Robbins, K. T. et al.: Management of the neck in cancer of the major salivary glands, thyroid and parathyroid. Acta Otolaryngol., 122, 2002, s. 673-678.
9. Frankenthaler, R. A., Byers, R. M., Luna, M. A. et al.: Predicting occult lymph node metastasis in parotid gland cancer. Arch. Otolaryngol. Head Neck Surg., 119, 1993, s. 517-520.
10. Frankenthaler, R. A.: Prognostic variables in parotid gland cancer. Arch. Otolaryngol. Head Neck Surg., 117, 1997, s. 1251-1256.
11. He, Y., Zhang, Z. Y., Tian, Z.: The diagnostic value of fine-needle aspiration cytology (FNAC) for lesions in the parotid gland. Shanghai Kou Quiang Yi Xue, 12, 2003, 6, s. 410-413.
12. Hosni, A., Huang, S. H., Goldstein, D. et al.: Outcomes and prognostic factors for major salivary gland carcinoma following postoperative radiotherapy. Oral Oncol., 54, 2016, s. 75-80.
13. Chaudhuri, R., Bingham, J. B., Crossman, J. E. et al.: Magnetic resonance imaging of the parotid gland using the STIR sequence. Clin. Otolaryngol. Allied Sci., 17, 1992, 3, s. 211-217.
14. Chen, A. M., Granchi, P. J., Garcia, J. et al.: Local-regional recurrence after surgery without post-operative irradiation for carcinomas of the major salivary glands: Implications for adjuvant therapy. Int. J. Radiat. Oncol. Biol. Phys., 67, 2007, s. 982-987.
15. Izzo, L., Casullo, A., Caputo, M. et al: Space occupying lesions of parotid gland. Comparative diagnostic imaging and pathological analysis of echo color/power Doppler and of magnetic resonance imaging. Acta Otorhinolaryngol. Ital., 26, 2006, 3, s. 147-153.
16. Jackson, G. L., Luna, M. A., Byers, R. M.: Results of surgery alone and surgery combined with pooperative radiotherapy in the treatment of cancer of the parotid gland. Amer. J. Surg., 146, 1983, s. 497-500.
17. Kawata, R., Koutetsu, L., Yoshimura, K. et al.: Indication for elective neck dissection for N0 carcinoma of the parotid gland: a single institution´s 20-year experience. Acta Oto-Laryngol., 130, 2010, s. 286-292.
18. Kelley, D., Spiro, R. H.: Management of the neck in parotid carcinoma. Amer. J. Surg., 172, 1996, s. 695-697.
19. Kinoshita, T., Ishii, K., Naganuma, H. et al.: MR imaging findings of parotid tumors with pathologic diagnostic clues: a pictorial essey. Clin. Imaging, 28, 2004, 2, s. 96-101.
20. Kiyoshi T.: Management of the facial nerve in parotid tumor surgery. In: Castro D. Proceedings of the sixth international symposium on the facial nerve. Rio De Janeiro, Brasil, 2-5 Oct., 1988.
21. Klussmann, J. P., Ponert, T., Mueller, R. P. et al.: Patterns of lymph node spread and its influence on outcome in resectable parotid cancer. EJSO, 34, 208, s. 939-937.
22. Kraft, M., Lang, F., Mihaescu, A. et al.: Evaluation of clinician-operated sonography and fine-needle aspiration in the assessment of salivary gland tumours. Clin. Otolaryngol., 33,2008, 1, s. 18-24.
23. Laurie, S. A., Licitra, L.: Systemic therapy in the palliative management of advanced salivary gland cancers. J. Clin. Oncol., 24, 2006, s. 2673-2678.
24. Lim, Y. C., Lee, S. Y., Kim, K. et al.: Conservative parotidectomy for the treatment of parotid cancers. Oral Oncol., 41: 2005, s. 1021-1027.
25. Medina, J. E.: Neck dissection in the treatment of cancer of major salivary glands. Otolaryngol. Clin. North Amer., 31, 1998, s. 815-921.
26. NCCN clinical practise guidelines in oncology. Head and neck cancers. Salivary gland tumors. www.nccn.org
27. North, C. A.: Carcinoma of the major salivary glands treated by surgery or surgery plus postoperative radiotherapy. Int. J. Radiat. Oncol. Biol. Physiol., 18:, 990, s. 1319-1326. 28. Pohar, S., Gay, H., Rosenbaum, P. et al.: Malignant parotid tumours: presentation, clinical/pathological prognostic factors and treatment outcomes. Int. J. Radiat. Oncol. Biol. Phys., 61, 2005, s. 112-118.
29. Que Hee, C. G., Perry, C. F.: Fine needle aspiration cytology of parotid tumours: is it useful? ANZ J. Surg., 71, 2001, 6, s. 345-348.
30. Renehan, A., Gleave, E., Slevin N. J. et al.: Clinico-pathological and treatment-related factors influencing survival in parotid cancer. Br. J. Cancer, 80, 1999, s. 1296-1300.
31. Rizk, S., Vandenjooft, A., Aoiroldi, M. et al.: Activity of chemotherapy in the palliative treatment of salivary gland tumors. Review of the literature. Eur. Arch. Oto-rhino-laryngology, 264, 2007, 6, s. 587-594.
32. Rodriguez-Cuevas, S., Labastida, L., Baena, I. et al.: Risk of nodal metastases from malignant salivary gland tumors related to tumor size and grade of malignancy. Eur. Arch. Otorhinolaryngol., 252, 1992, s. 139-142.
33. Santos, I. R., Kowalski, L. P., Araujo, V. C. et al.: Multivariate analysis of risk factors for neck metastases in surgically treated parotid carcinomas. Arch. Otolaryngol. Head. Neck. Surg., 127, 2001, s. 56-60.
34. Speight, P. M., Barrett, A. W.: Salivary gland tumors. Oral Diseases, 2002, 8, s. 229-240.
35. Schwentner, I., Obrist, P., Thumfart, W. et al.: Distant metastasis of parotid gland tumors. Acta Otolaryngol., 126, 2006, 4, s. 340-345.
36. Stennert, E., Kisner, D., Jungehuelsing, M. et al.: High incidence of lymph node metastasis in major salivary gland cancer. Arch. Otolaryngol. Head Neck Surg., 129, 2003, s. 720-723.
37. Terhaard, C. H. J., Lubsen, H., Rasch, C. R. N. et al.: The role of radiotherapy in the treatment of malignant salivary gland tumours. Int. J. Radiat. Oncol. Biol. Phys., 61, 2005, s. 103-111.
38. Teymoortash, A., Werner, J. A.: Value of neck dissection in patients with cancer of the parotid gland and a clinical N0 neck. Oncol. Res. Treat., 25, 2002, s.122-126.
39. Zbären, P., Schüpbach, J., Nyuns et al.: Elective neck dissection versus observation in primary parotid carcinoma. Otolaryngol. Head Neck Surg., 132, 2005, s. 387-391.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)Article was published in
Otorhinolaryngology and Phoniatrics

2017 Issue 3
Most read in this issue
- Léčba náhle vzniklé idiopatické percepční nedoslýchavosti - hyperbarická oxygenoterapie
- Doporučené postupy v diagnostice a léčbě nádorů příušní žlázy
- Adenoidně cystický karcinom boltce
- Netraumatická rinolikvorea
