Význam elevace hladin metalothioneinu v krvi u pacientů s nádory hlavy a krku – 2. část
Importace of Elevation of Metallothionein Blood Levels in Patients with Head and Neck Tumors - Part 2
Diagnostics of head and neck tumors is far from being easy and most of them are verified in advanced state. One of the reasons might be absence of a reliable diagnostic tumor marker. Authors of the following prospective study evaluated possibility of using methaleothionein as a blood tumor marker. The analysis confirmed significantly elevated level in patients with spinocelullar oropharyngeal carcinoma in comparison with a contol group. MT as diagnostic marker proved to be of a high sinsitivity a specificity. MT level didn’t correlate with any futher tumor characteristics.
Key words:
methaleothionein, oropharyngeal carcinoma, tumor marker.
Authors:
Z. Horáková 1
; E. Tóthová 1; Richard Salzman 1
; H. Binková 1; I. Fabrik 2; P. Smilek 1; R. Kizek 2
Authors‘ workplace:
Klinika otorinolaryngologie a chirurgie hlavy a krku LF MU a FN u sv. Anny, Brno
; přednosta prof. MUDr. R. Kostřica, CSc.
Ústav chemie a biochemie, Agronomická fakulta Mendelovy zemědělské a lesnické univerzity, Brno
1; přednosta doc. RNDr. P. Hrdlička, CSc.
2
Published in:
Otorinolaryngol Foniatr, 57, 2008, No. 2, pp. 90-97.
Category:
Comprehensive Reports
Overview
Diagnostika nádorů hlavy a krku je složitá a většina z nich je verifikována až v lokálně pokročilém stadiu. Jedním z důvodů může být i absence spolehlivého diagnostického markeru. Autoři následující prospektivní studie hodnotili možnosti využití hladiny metalothioneinu (MT) v krvi jako nádorového markeru. Analýza potvrdila statisticky významně elevovanou hladinu u pacientů s karcinomy orofaryngu a ústní dutiny ve srovnání s kontrolní skupinou. MT jako diagnostický marker vykazoval vysokou senzitivitu i specificitu. Hodnoty MT nekorelovaly s dalšími charakteristikami nádoru jako TNM nebo grading.
Klíčová slova:
metalothionein, karcinom orofaryngu, nádorový marker.
ÚVOD
V USA je ročně stanoveno cca 45 000 nových nádorů hlavy a krku, v Česku asi 3500 a incidence v posledních desetiletích kontinuálně stoupá. Přes veškeré úsilí a implementaci nových terapeutických postupů do klinické praxe se nepodařilo za posledních 30 let dosáhnout podstatného poklesu morbidity a mortality. Jejich prognóza patří mezi jednu z nejhorších vůbec. Dlouhodobě se pohybuje cca na 55 % pětiletého přežití souhrnně pro všechny malignity hlavy a krku. U lokálně pokročilých, stále však kurabilních nádorů, pětileté přežití zůstává na úrovni cca 30 %.
Prognóza závisí na mnoha klinicko-patologických faktorech (lokalita, velikost tumoru, status lymfatických uzlin, grading, histologie, hloubka invaze, vzdálená diseminace). Jedná se o standardizované parametry, které bývají stanovovány rutinně u každého pacienta před léčbou (14, 31). Významnou negativní roli sehrává velká variabilita tumorů. Tato skutečnost by měla být podnětem pro další podrobnější studium biologie nádorů. Adjuvantní markery charakterizující nádory a predikující jejich chování by umožnily přesnější stratifikaci léčby s očekávaným benefitem pro pacienta.
Na základě dostupných literárních informací hraje ve složitém procesu kancerogeneze svou zatím neúplně objasněnou roli také metalothionein (MT). Dosud byly publikovány studie zabývající se overexpresí MT v různých typech nádorů. V mnoha případech korelovala s charakteristikami tumorů a predikovala jejich biologické chování. Ve všech případech byl MT studován výhradně po imunohistologickém zpracování jako tkáňový marker.
V naší prospektivní studii jsme vycházeli z výše zmíněných dostupných poznatků o MT a jeho vztahu k maligním nádorům. Předpokládali jsme, že patologická exprese v nádorové tkáni může indukovat elevaci MT v tělních tekutinách. Elektrochemickou metodou jsme stanovili MT v plné krvi a ověřovali jsme možnosti využití MT jako potenciálního diagnostického či prognostického markeru.
KLINICKÝ MATERIÁL
Soubor pacientů
Soubor tvořili pacienti s maligními nádory hlavy a krku léčení na Klinice ORL a chirurgie hlavy a krku Fakultní nemocnice U svaté Anny v Brně v období od ledna do prosince roku 2006. Podmínkou zařazení byla histologická verifikace dříve neléčeného maligního tumoru. U všech pacientů byl z probatorní excize histologicky verifikován karcinom, stanovena přesná diagnóza, včetně TNM klasifikace. Ze studie byli vyloučeni pacienti s hematologickými malignitami, s kožními nádory, s recidivami primárních tumorů a pacienti s duplicitními nádorovými onemocněními. Ve sledovaném časovém období bylo verifikováno 159 primozáchytů zhoubných nádorů splňující výše zmíněné podmínky, 134 mužů a 25 žen. Naší snahou v rámci této pilotní studie bylo vytvoření maximálně homogenního souboru onkologických pacientů. Proto jsme zvolili pacienty s nádory pouze vybrané lokalizace, konkrétně ústní dutiny a orofaryngu, a jednoho histologického typu, kterým byl spinocelulární karcinom. Vzorky plné krve k analýze byly odebrány po histologické verifikaci před zahájením terapie.
Hodnoceno bylo celkem 73 pacientů.V souboru bylo 61 mužů a 12 žen (graf 1), jejich věkový průměr činil 59,70 ± 9,61 let (medián 58; min. 40, max. 88). Při rozdělení spinocelulárních karcinomů dle stupně diferenciace jsme nejčastěji nalezli typ středně diferencovaný (46), dále nízce diferencovaný (17), dobře diferencovaný (8) a nediferencovaný (2). Pokročilost onemocnění byla hodnocena dle mezinárodní TNM klasifikace. Většina nádorů byla diagnostikována až v pokročilém stadiu (st. IV-59, st. III-9, st. II-4, st. I-1). (graf 2). Rovněž podle hodnot T převažovaly lokálně pokročilé nádory (T 4-41, T 3 - 9, T2-17, T 1-6). (graf 3). O relativně vysokém metastatickém potenciálu svědčí nádorové postižení krčních lymfatických uzlin u vysokého podílu pacientů v době verifikace (N3-7, N2-43, N1-9, N0-14; N+ vs N0: 59 vs 14) (graf 4). Vzdálené metastázy jsou u karcinomů hlavy a krku vzácné, vyskytly se pouze v jednom případě.




Jak odpovídá literárním údajům o etiopatogenetickém vlivu kouření - jednoznačně převažovali kuřáci (62) nad nekuřáky (11). Výraznější abusus alkoholu, tj. více než 3 j./den, byl zaznamenán u 28 pacientů. Pro hledání dalších možných korelací a pochopení mechanismu elevujícího hladinu MT bylo sledována také míra zánětlivé odpovědi organismu na hodnotách zánětlivých laboratorních markerů. U 27 nemocných byla hodnota CRP elevována nad fyziologickou normu (10 mg/l). Ze známých interkurencí, které by mohly ovlivňovat hladinu MT, jsme sledovali hepatopatie pomocí hodnot jaterních enzymů. U 3 pacientů byla zvýšena nad normu ALT (0,78 ukat/l), AST (0,79 ukat/l), u 12 pacientů GMT (1,77 ukat/l).
V souboru pacientů jednoznačně dominovali nemocní s lokálně pokročilým, často inoperabilním onemocněním. Ve 13 případech velmi pokročilých nádorů mohla být aplikována pouze paliativní RT, v 1 případě pouze symptomatická terapie. Ve 3 případech nebyla terapie pro nízkou complianci dokončena. U 50 pacientů bylo léčbou dosaženo kompletní remise; 23 léčených pacientů remise nedosáhlo. Z 50 pacientů, kteří léčbou dosáhli kompletní remisi onemocnění, byla v 10 případech za dobu sledování verifikována recidiva. Z celého souboru nemocných bylo zaznamenáno 26 případů úmrtí, z nichž bylo 24 v souvislosti s nádorem; 47 pacientů dosud přežívá. Medián doby sledování pacientů od ukončení terapie v našem souboru činil 10,8 měsíců (min. 1; max. 19,9). Při hodnocení parametrů přežití jsme použili Kaplan- Meierovy křivky pro kumulativní celkové přežití (over all survival - AOS) (graf 5) a pro období bez recidivy (desease free interval-DFI) (graf 6). Vzhledem ke krátké době sledování jsme mohli získat pouze 12 a 18měsíční hodnoty parametrů. 12měsíční DFI dosáhlo 80 % léčených, 18měsíční 75 %. Celkové 12měsíční přežití (OAS) dosáhlo 68 % nemocných a 18měsíční 43 %. Přežití s ohledem na základní diagnózu (DSS) bylo pro 12 měsíců 70 % a pro 18 měsíců 45 %.


Kontrolní soubor
Hodnoty MT u pacientů s onkologickým onemocněním jsme srovnávali s kontrolní skupinou, kde byly krevní vzorky odebrány se souhlasem pacientů v rámci preventivní prohlídky v Ústavu sportovní medicíny. Tento soubor představoval vzorek běžné dospělé populace. Skupinu tvořilo 58 zdravých jedinců. Ve skupině byla zastoupena obě pohlaví; 18 žen a 40 mužů. Všichni byli ve věkové kategorii mezi 15 a 52 lety, věkový průměr byl 32,0 ± 12,4, medián 30 let. Zastoupeni byli kuřáci (9) i nekuřáci (49). U nikoho se nevyskytlo v anamnéze onkologické onemocnění. Hodnoty jaterních testů i zánětlivých markerů byly v čase odběru v normě.
METODIKA
Elektrochemické stanovení metalothioneinu v krvi
Ze získaných vzorků plné krve bylo odebráno 100 μl a umístěno na 15 min. při 99 °C do termobloku (Eppendorf 5430, USA). Poté byly vzorky ochlazeny na 4 oC a centrifugovány při 4 °C, 15 000 g po dobu 30 min. (Eppendorf 5402, USA). Metalothioneiny patří k termostabilním proteinům, které zůstávají přítomné v roztoku i po jeho tepelné denaturaci. Takto připravené vzorky byly analyzovány námi upraveným postupem adsorptivní přenosové techniky (AdTS) s diferenční pulzní voltametrií (DPV) na přístroji AUTOLAB v klasickém tříelektrodovém uspořádání. AdTS DPV parametry byly následující: čas akumulace 120 s, počáteční potenciál –0,6 V, konečný potenciál –1,6 V, modulační čas 0,057 s, časový interval 0,2 s, potenciálový krok 1,05 mV/s, modulační amplituda 250 mV, Eads = 0 V, teplota 20 °C. Množství analyzovaného vzorku bylo 5 μl, koncentrace MT byly stanovovány v μM (14).
Statistické zpracování a interpretace získaných dat
Ke statistickému zpracování jsme použili běžné neparametrické testy (Spearmanova korelace, Mann-Whitneyův U-test a Kruskal-Wallisovu ANOVA) pro srovnání rozdílu mezi hodnotami MT mezi jednotlivými skupinami. Pro srovnání hladiny MT mezi skupinami spárovanými podle pohlaví a věku jsme použili parametrický Studentův T-test. K určení délky bezpříznakového období byla použita Kaplan - Meierova analýza přežívání. Hladinu P< 0,05 jsme považovali za statisticky signifikantní. Veškeré statistické analýzy byly zpracovány pomocí statistické programu STATISTICA for Windows v 7.1 (Statsoft Inc., Tulsa, OK, USA).
VÝSLEDKY
Elektrochemickou metodou měření jsme stanovili hladiny MT v plné krvi v souboru onkologických pacientů. Získané hodnoty byly statisticky vyhodnoceny a korelovány se zavedenými onkologickými klinicko-patologickými parametry. Průměrná hladina MT byla 2,73 ± 1,19 μM (medián 2,40, min. 0,74, max. 6,38). Hladiny MT se významně nelišily u mužů a u žen, p=0,5 (Mann-Whitney). Při další analýze naměřených hodnot MT nebyla nalezena souvislost mezi koncentracemi MT a věkem, p=0,98, R= -0,002 (Spearman). Statisticky významný rozdíl jsme nezjistili mezi skupinami kuřáků a nekuřáků, p=0,88 (Mann- Whitney). Abychom vyloučili vliv abusu alkoholu a hepatopatie na elevaci MT v krvi, porovnali jsme vzájemně skupinu pacientů s normálními a zvýšenými hodnotami GMT. Obě skupiny se v hodnotách MT statisticky nelišily, p=0,15 (Mann- Whitney). K vyloučení vlivu současně probíhajících zánětlivých změn jsme srovnali pacienty s normálními a elevovanými hladinami CRP. Ani tyto skupiny se v hodnotách MT statisticky neodlišovaly, p=0,29 (Mann-Whitney).
Primárním účelem této studie bylo srovnání skupiny onkologických pacientů s kontrolní skupinou zdravých jedinců. Hodnoty hladiny MT v plné krvi u kontrolní skupiny byly 0,50 ±0,20 μM (medián 0,49; min. 0,17, max. 0,90). Ve srovnání souboru mužů a žen nebyl nalezen rozdíl mezi pohlavími, p=0,07 (Mann-Whitney). Významný nebyl ani rozdíl mezi kuřáky a nekuřáky, p=0,80 (Mann- Whitney). Statisticky významně nekorelovala hladina MT s věkem, p=0,24, R=0,16 (Spearman).
Při vzájemném srovnání obou skupin byla zřejmá signifikantní elevace hladin u onkologicky nemocných. Odlišnost obou skupin je patrná i na histogramu hodnot MT (graf 7). Výsledek byl jednoznačně statisticky významný, p ‹10-6 (Mann-Whitney) (graf 8). U obou srovnávaných souborů jsme vzhledem k odlišnému složení k validizaci výsledků provedli párové srovnání spárovaných skupin podle věku a pohlaví (age/sex matched). I tento párový Studentův T test potvrdil významnou rozdílnost obou skupin v hladinách MT, p‹10-6, n=17.


Hladiny MT byly dále korelovány se standardními klinickými a histopatologickými parametry nádoru. Hodnotili jsme nádory podle lokální pokročilosti definované hodnotou T, tj časná stadia proti lokálně pokročilým nádorům. Mezi oběma skupinami nebyl patrný rozdíl, T1+2 vs 3+4 : p=0,56 (Mann-Whitney) (graf 9). MT významně nesouvisel s pokročilostí nádorů dle stadia, st. I+II vs st. III+IV : p=0,87 (Mann-Whitney). Ke zhodnocení korelace MT s metastatickým potenciálem jsme srovnali skupinu N0 vs N+ , nebyla zjištěna rozdílnost obou skupin, N0 vs N+ p=0,43 (Mann-Whitney) (graf 10). Dále byly vzájemně porovnány všechny hodnoty N. Neodlišovaly se sice statisticky významně, nicméně na grafickém znázornění je patrný rozdíl N3 od ostatních hodnot N0-N2; p=0,15 (Kruskal-Wallis). Z histologického hlediska byly korelovány různé stupně diferenciace, grading, spinocelulárních karcinomů. Skupiny dobře a středně diferencovaných proti nízce a nediferencovaným spinocelulárním karcinomům. MT nekoreloval s gradingem, p=0,87 (Mann-Whitney). Z hlediska prognózy jsme korelovali parametry DFI s MT. Inverzní korelace MT s délkou období bez recidivy zde sice byla naznačena, nikoliv však na statisticky významné úrovni, p=0,17, R= -0,19, n=49 (Spearman) (graf 11).



DISKUSE
Jako nádorový marker lze označit jakýkoliv znak, který s dostatečnou senzitivitou a specificitou odlišuje nádorový proces, specifickou skupinu nádorů, specifickou vlastnost nádoru atd. Spolehlivě by měl odlišit nádorovou a nenádorovou buňku a měl by být měřitelný v tělních tekutinách, tkáních či v samotném nádoru. Jejich specificita, ale hlavně senzitivita jsou limitovány celou řadou faktorů. Většinou negativní nález nevylučuje přítomnost zhoubného nádoru. Nádorové markery jsou klinicky využitelné pro určení: 1. rizika vzniku, 2. přítomnosti, 3. prognózy, 4. účinnosti terapie, 5. rizika metastáz nebo reziduální choroby nádorového onemocnění (12).
Sérové, resp. krevní markery, obecně mají v klinické praxi široké využití. Jejich absence v onkologii hlavy a krku se stává výzvou pro další studium. V literatuře nacházíme mnoho publikací hledajících nádorové markery pro tumory hlavy a krku. Jednotliví autoři buď se snažili ověřit aplikovatelnost již klinicky etablovaných markerů pro jiné diagnózy, nebo studovali zcela nové substance na základě hypotéz o kancerogenezi a biologii nádorů. Některé markery na limitovaném souboru prokázaly svůj význam, většinou pouze izolovaně, nejčastěji jako monitorující, méně často jako diagnostické či prognostické. Všechny zmiňované markery jsou zatím ve stadiu primárního výzkumu.Doposud žádný nedosáhl takového významu, který by ho opravňoval ke klinickému využití.
Kuropkat sledoval hladiny M-CSF (Macrophage colony stimulating factor) v séru u pacientů se spinocelulárními karcinomy hlavy a krku (SCCHN). Byly zjištěny signifikantně vyšší hladiny M-CSF ve srovnání s kontrolní skupinou zdravých jedinců. M-CSF koncen-trace v séru nekorelovala s velikostí tumoru podle TNM (16). Kuropkat v další studii hodnotil hladiny MMP 3,8 a 9 (matrix metaloproteise) a M-CSF. Proti kontrolní skupině ukázaly výsledky u SCCHN přesvědčivou korelaci hladin MMP 3, 8 a M-CSF s přítomností nádorového onemocnění (17). Doweck sledoval hladiny cyfry 21-1 (fragment cytokeratinu 19) v séru u 38 pacientů se SCCHN. Před zahájením léčby u onkologicky nemocných pacientů byla potvrzena signifikantní elevace cyfry 21-1 ve srovnání s kontrolní skupinou. Při porovnání jejích počátečních hodnot s parametry přežití a ve vztahu s TNM, byla cyfra 21-1 nezávislým prognostickým markerem. Při dlouhodobé monitoraci došlo k poklesu hodnot pooperačně po odstranění tumoru do 24 hodin a v případě recidivy k opětovnému vzestupu; s pozitivní prediktivní hodnotou 75 %. Během radioterapie ukazovaly konstantně zvýšené hladiny cyfry 21-1 na kontinuální buněčnou smrt korelující s postradiační nekrózou. Na základě těchto výsledků považují autoři cyfru 21-1 za možný nádorový a prediktivní marker pro karcinomy hlavy a krku (9). Céruse ve studii zahrnující 300 pacientů s neléčenými verifikovanými SCCHN potvrdil dosaženými výsledky možnosti využití cyfry 21-1 jako tumorózního markeru. Už v pilotní studii autoři prokázali signifikantně elevovanou hladinu(8). Bongers, Kuropkat,Ogawa, Lee na vlastních souborech rovněž potvrdili významnou elevaci tohoto markeru u karcinomů hlavy a krku (5, 18, 23, 20). Negativního výsledku na rozdíl od výše zmíněných autorů dosáhl Yen (167 pacientů). Cyfra 21-1 nepotvrdila svůj potenciál nezávislého screeningového markeru, nicméně značnou senzitivitu prokázala při monitoraci recidivy (33). TATI (tumor associated trypsin inhibitor) je peptid příbuzný pankreatickému sekretorickému trypsin inhibitoru. Ve zvýšené koncentraci byl zjištěn u mnoha různých nádorových onemocnění. Goumas ve své práci stanovoval TATI spolu s cyfrou 21-1 u SCCHN. Senzitivita, resp. specificita TATI, byla stanovena na 67 %, resp. 94 %, u cyfry 29 %, resp. 95 %. Oba markery signifikantně poklesly po radikální léčbě, korelovaly s diferenciací SCCHN (11). Squamous cell carcinoma antigen (SCCAg) je dobře známý tumor marker epidermálních karcinomů cervixu, plic, jícnu. Lara stanovil tento antigen u laryngeálního karcinomu. Elevace SSCAg byla zjištěna se senzitivitou 78 %, korelovala dobře s hodnotami T a perzistencí po ukončené terapii. K reelevaci došlo zhruba 3 měsíce před histologickou verifikací recidivy. Poléčebné hodnoty byly naopak výbornými predikčními údaji (19). Pectisides potvrdil SCCAg jako marker reziduální nemoci a časný prediktor relapsu (25).
Mnoho dalších autorů se snažilo najít klinické využití pro SCCAg u karcinomů hlavy a krku, většinou s nepřesvědčivými výsledky. Malina u pacientů se SCCHN stanovoval hladinu TPA (tkáňový polypeptidový antigen) a TPS (polypeptidový specifický antigen, tissue polypeptide antigen). TPS byl signifikantně elevován proti kontrolní skupině. Nejvýznamnější byly výsledky u dlouhodobé monitorace pacientů a časné detekce recidivy (22). Anttonen sledoval sérový solubilní syndecan 1 u SCCHN. Potvrdil se význam jako monitorujícího a prognostického markeru (2).Warawdekar verifikoval statisticky významnou elevaci cFN (celulární fibronektin) u pacientů se SCCHN (65 % pacientů s nádorem mělo koncentrace nad 80 normálních hodnot (32). Kuratomi hodnotil laminin gamma 2 na souboru pacientů se SCCHN před léčbou. Elevaci hladiny v séru zjistil pouze ve 33 % případů. Dobře korelovala se špatnou prognózou přežití, resp. s perzistencí nádoru po léčbě (15). Strojana sledoval předléčebné sérové koncentrace cystatinu C (inhibitor cysteinové proteázy), byly významně elevovány, cystatin C koreloval s invazivitou nádorů a s TNM (28, 29). Solubilní formy adhezivních molekul E cadherinu, E selektinu, ICAM-1 (intercelulární adhezivní molekula) a PSA (protein vázaný sialovou kyselinou) byly zjištěny ve zvýšené koncentraci v krvi u pacientů s SCCHN, v některých případech korelovaly částečně s TNM nebo recidivou tumoru (1, 4, 21). Papadimitrakupoulou potvrdil sníženou expresi insulin-like growth faktoru během kancerogeneze a pokles sérové hodnoty za negativní prognostický faktor u SCCHN (24). Z multifunkční cytokin TNF α (tumor necrosis factor α) nebo proteiny akutní fáze neměly žádný podstatný vztah k SCCHN (27). Výsledky potvrdily pouze význam sérového IL2, IL8 a IL6 jako prognostických faktorů dobře korelujících s parametry přežití (26, 30). Hladiny VEGFR1 (vascular endothelial growth factor receptor) a EGFR (epidermal growth factor receptor) a zejména VEGF (vascular endothelial growth factor) v séru u pacientů se SCCHN byly hodnoceny v rámci mnoha studií, neprokázaly však žádný podstatnější význam (10). Význam genu p 53 v kancerogenezi je obecně uznáván, sérové hodnoty proteinu se však stanovují výjimečně. Chaw sledoval prognostickou hodnotu p 53 sérového proteinu a anti p 53 protilátky. Předléčebné hodnoty pacientů byly vyšší než u kontrol. Signifikantně korelovaly s postižením LU (7).Buntzel se věnoval studiu vztahu hladiny selenu v séru k nádorovému onemocnění. Koncentrace sérového selenu signifikantně korelovala s objemem tumoru u lokálně pokročilého nádoru hlavy a krku (6). Overexpreseantigenu CD 44 byla zjištěna u některých epiteliálních typů nádorů. Andratschke nepotvrdil CD 44v6 jako tumor markeru u SCCHN (3) .
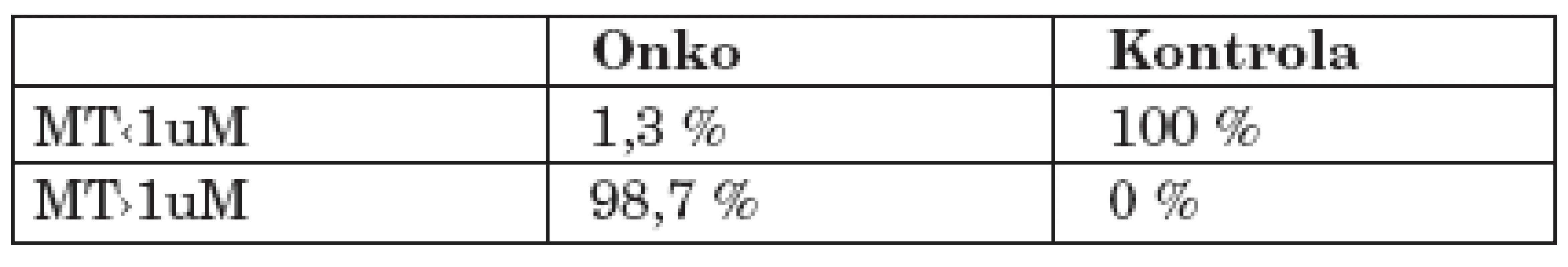
V našem souboru onkologicky nemocných jsme stanovovali hladinu MT v plné krvi. Získané hodnoty byly dále porovnávány s kontrolní neonkologickou skupinou. Výsledek potvrdil statisticky významný rozdíl mezi oběma skupinami. K vyloučení možného zkreslení při odlišném věkovém složení jsme provedli párový Studentův T test, který porovnal věkově odpovídající části obou souborů. Tím byla potvrzena signifikantní odlišnost obou skupin. Z grafického znázornění je jednoznačně patrné odlišné rozložení hodnot koncentrací MT. Experimentálně lze za hraniční hodnotu fyziologické normy považovat koncentraci MT 1uM. Celý soubor kontrolních vzorků splňoval stanovenou podmínku, všechny koncentrace byly nižší než tato hodnota. Naopak v souboru onkologických pacientů byla pouze jednou zjištěna hodnota nižší než 1 uM. Ve všech ostatních případech byla hodnota elevovaná. Pokud bychom považovali hladinu 1uM MT v krvi za normální, pak bylo v našem kontrolním souboru 100 % hodnot v normě a v souboru onkologických pacientů 98,7 % vzorků nad normou (tab. 1). Na základě analyzovaných výsledků byla stanovena senzitivita daného markeru 99%, specificita 100%, pozitivní prediktivní hodnota 100% a negativní prediktivní hodnota 98% (tab. 2).

Verifikace významné elevace MT v krvi v souvislosti s výskytem malignity lze považovat za klinicky nejvýznamnější výsledek. MT se ukázal jako vysoce senzitivní i specifický diagnostický marker. Podařilo se najít jasně definovanou hraniční hodnotu, která s vysokou spolehlivostí odlišila zdravé a onkologicky nemocné. Přes přesvědčivost získaných výsledků jsme si vědomi rizika spojeného s relativně nízkým počtem v obou souborech. K získání dalších informací a objektivizaci výsledků plánujeme navázat rozsáhlejší prospektivní studii, která by zahrnovala větší počet pacientů s karcinomy dalších lokalit hlavy a krku.
Na stávajícím souboru jsme hledali bližší souvislosti mezi hodnotami MT a konkrétními parametry onemocnění. Nebyla zjištěna souvislost MT s pokročilostí nádorů hodnocených podle T, resp. stadia mezinárodní klasifikace. MT hladina nebyla ani významněji ovlivněna metastatickým potenciálem nádorů, nelišily se skupiny nemetastazujících nádorů od N+. MT nekorelovala s histologickým gradingem, který může být považován za další z parametrů agresivity nádoru. Pro parametry přežívání jsme doposud získali pouze krátkodobé výsledky pro 12 a 18 měsíců. Ani z těchto předběžných výsledků žádná korelace s MT nebyla patrná. V mnoha literárních odkazech o expresi MT v nádorové tkáni bylo konstatováno, že exprese MT lze považovat za negativní prognostický marker, resp. marker agresivního chování nádoru. Verifikován byl jeho vztah k agresivnějšímu chování, nižší diferenciaci, pokročilému stadiu, resp. horším parametrům přežití. Podobnou korelaci jsme ověřovali i na našem souboru. Nepodařilo se však najít vztah mezi krevní hladinou MT k žádnému ze sledovaných charakteristik nádoru ani parametru přežívání.
Otázkou do budoucnosti zůstává možnost využití MT také jako prognostického, prediktivního, resp. monitorujícího markeru. Odpověď může přinést srovnání MT s parametry přežití (OAS a DFS) při dlouhodobějším sledování pacientů. Při zjištěné souvislosti hladiny MT s horší prognózou pacientů bychom získali prostředek k selekci pacientů vyžadujících razantnější protinádorovou léčbu. Další eventualitou může být využití MT jako monitorujícího markeru; tj. sledování MT během dispenzarizace pacientů. Případná korelace s klinickým stavem by usnadnila včasnou diagnostiku recidivy onemocnění. Předmětem dalšího sledování zůstává souvislost hladiny MT s rezistencí na léčbu cisplatinou. Ověření hypotézy by podpořilo význam MT jako prediktivního markeru chemorezistence.
ZÁVĚR
V prospektivní studii byl hodnocen soubor pacientů s karcinomem orofaryngu. Naměřené hodnoty MT v krvi před zahájením léčby byly analyzovány, srovnávány s kontrolní skupinou a hodnoceny souvislosti s klinicko-patologickými charakteristikami onemocnění. Výsledky potvrdily, že koncentrace MT v krvi u onkologicky nemocných se statisticky významně lišila od kontrolní skupiny. Experimentálně jsme stanovili hraniční hodnotu pro diferenciaci fyziologických a patologických hodnot na 1uM. Za těchto podmínek by MT jako onkologický diagnostický, resp. screeningový marker, vykazoval vysokou senzitivitu, resp. specificitu (99%, resp. 100%).
Hypotéza o možné souvislosti MT s bližšími charakteristikami nádorového onemocnění naopak potvrzena nebyla. Hodnoty MT nekorelovaly s pokročilostí nádoru, metastatickým potenciálem ani gradingem nádorů.
Otázkou do budoucnosti zůstává možnost využití MT jako monitorujícího, prognostického, resp. prediktivního markeru, při časné diagnostice recidiv, selekci pacientů s horšími parametry přežití, resp. identifikaci chemorezistentních nádorů.
Došlo 13. 11. 2007
MUDr. Zuzana Horáková
KOCHHK FN U sv. Anny
Pekařská 53
656 91 Brno
e-mail:zuzana.horakova@fnusa.cz
Sources
1. Akcay, F., Taysi, S., Uslu, C., Dogru, Y.: Gümüstekin levels of soluble intercellular adhesion molecule-1 and total sialic acid in serum of patients with laryngeal cancor. Japanese Journal of Clinical Oncology, 31, 2001, s. 12-15.
2. Anttonen, A., Leppa, S., Heikkila, P., Grenman, R., Joensuu, H.: Effect of treatment of larynx and hypopharynx carcinomas on serum syndecan-1 concentratins, Journal of Cancer Research and Clinical Oncology, 10, 2006, s. 1007-1012.
3. Andratschke, M., Chaubal, S., Pauli, C., Mack, B., Hagedorm, H., Wollenberg, B.: Soluble CD 44v6 is not a sensitive tumor marker in patients with head and neck squamous cell cancer. Anticancer Research, 25, 2005, s. 2821-2826.
4. Bhatavdekar, J., Vora, H., Patel, D.: Serum sialic acid forms as markers for head and neck malignancies. Neoplasma, 35,1988, s. 250-255.
5. Bongers, V., Braaknuis, B. J., Snow G. B.: Circulating fragments of cytokeratin 19 in patients with head and neck squamous cell carcinoma. Clin Otolaryngol, 20,1995, s. 479-482.
6. Buntzel, J., Micke, O., Glatzel, M., Frohlich, D., Bruns, F., Mucke, R., Schonekaes, K.: Serum selenium in head and neck cancer patients- A new marker of tumor aktivity. Anticancer Research, 25, 2005, s. 1711-1712.
7. Chow, V., Yuen, A., Lam, K., Ho, W., Wei, W.: Prognostic significance of serum p53 protein and p53 antibody in patients with surgical treatment for head and neck squamous cell carcinoma. Head Neck, 23, 2001, s. 286-291.
8. Céruse, P., Rabilloud, M., Charrié, A., Dubreuil, C., Disant, F.: Study of cyfra 21-1, a tumor marker in head and neck squamous cell carcinoma. Laryngoskope, 109, 2006, s. 517-523.
9. Doweck, I., Barak, M., Urin, N., Greenberg, E.: The prognostic value of the tumour marker cyfra 21-1 in carcinoma of head and neck and its role in early detection of recurrent disease. British Journal of Cancor, 83, 2000, s. 1696-1701.
10. Godhale, A., Haddad, R., Cavacini, L., Wirth L. et al.: Serum concentrations of interleukin 8, vascular endothelial growth factor and epidermal growth factor receptor in patients with squamous cell cancer of the head and neck. Oral Oncol, 41, 2005, s. 70-76.
11. Goumas, P., Mastronikolis, N., Mastrokou, A., Vassilakos, P., Nikiforidis, G.: Evaluation of TATI and cyfra 21-1 in patients with head and neck squamous cell carcinoma, ORL, 59, 1997, s. 106-114.
12. Hajdúch, M., Jarošová, M., Trojanec, R., Indrák, K., Špačková, K., Papajík, T., Cwiertka, K.: Cytogenetické a molekulárně biologické markery v onkologii solidních nádorů a hematologických malignit. Klinická onkologie, suplement, 2004, s. 51-56.
13. Hardisson, D.: Molecular pathogenesis of head and neck squamous cell carcinoma. Eur Arch Otorhinolaryngol, 260, 2003, s. 502-508.
14. Kizek, R., Trnková, L., Paleček, E.: Determination of metallothionein at the femtomole level by constant current stripping chronopotentiometry. Anal. Chem., 73, 2001, s. 4801-4807.
15. Kuratomi, Y., Katayama, M., Kidera, K., Hayashida, S. et al.: Blood concentration of laminin gamma 2 chain in patients with head and neck cancer. Nippon, Saga University (on line) 109, 2006, s. 517-523.
16. Kuropkat, C., Dünne, A. A., Plehn, S., Ossendorf, M., Herz, U., Renz, H., Werner, J. A.: Macrophage colony-stimulating factor as a tumor marker for squamous cell carcinoma of the head and neck, Tumor Biology, 25, 2003, s. 236-240.
17. Kuropkat, C., Lippert, B. M., Werner, J. A.: Follow up with serum cyfra 21-1 in patients with squamous cell carcinomas of the head and neck. Oncology, 63, 2002, s. 312-318.
18. Kuropkat, C., Duenne, A. A., Herz, U., Renz, H., Werner, J. A.: Significant correlation of matrix metalloproteinase and macrophage colony-stimulating factor serum concentrations in patients with head and neck cancer, Neoplasma, 51, 2004, s. 51-55.
19. Lara, P., Cuyas, J.: The role of squamous cell carcinoma antigen in the management of laryngeal and hypopharyngeal cancer. Cancer, 76, 1995, s. 758-764.
20. Lee, J. K., Hiseh, J. F., Tsai, S. C., Ho, Y. J. et al.: Comparison of cyfra 21-1 and squamous cell carcinoma antigen in detectin nasopharyngeal carcinoma. Annal of Otology, Rhinology and Laryngology, 110, 2001, s. 775-773.
21. Liu, C., Sheen, T., Ko, J., Shun, C.: Circulating intercellular adhesion molecule 1, E selectin and vascular cell adhesion molecule 1 in head and neck cancer. British Journal of Cancer, 79, 1999, s. 360-362.
22. Malina, R., Torres, M., Moragas, M., Filella, X., Jo, J., Gimonez, N., Traserra, J., Ballesta, A.: Prognostic value of TPS in patients with head and neck malignancies: comparison with SCC. Anticancer Research, 15, 1995, s. 479-484.
23. Ogawa, T., Tsurusako, Y., Nobuhiko, K., Shinji, N., Akagi, H., Nishizaki, K., Nishioka, K., Rutka, J.: Comparison of tumor markers in patients with squamous cell carcinoma of the head and neck. Acta Otolaryngol, suppl., 540, 1999, s. 72-76.
24. Papadimitrakupoulou, B. A., Brown, E. N., Liu, D. D., El Naggar, A. K., Lee, J. J., Hong, W. K., Lee, H. Y.: The prognostic role of loss of insulin like growth factor binding protein 3 expression in head and neck carcinogenesis. Cancer Letters, 239, 2006, s. 136-143.
25. Pectisides, D., Bouzaranis, J., Economides, N., Pozadzidou, P., Gogou, L., Koutsiouba, P.: Squamous cell crcinoma antigen, carcinoembryonic antigen and tumor associated trypsin inhibitor for monitoring head and neck cancer. Int. J. Biol. Markers, 8, 1993, s. 81-87.
26. Riedel, F., Zaiss, I., Herzog, D., Gotte, K., Naim, R., Hormann, K.: Serum levels of interleukin 6 in patiets with primary head and neck squamous cell carcinoma. Anticancer Res., 25, 2005, s. 2761-2765.
27. Soylu, L., Ozcan, C., Cetik, F., Paydas, S., Kiroglu, M. et al.: Serum levels of tumor necrosis factor in squamous cell carcinoma of the head and neck. Am. J. Otolaryngol, 15, 1994, s. 281-285.
28. Strojan, P., Svetic, B., Smid, L., Kos, J.: Serum cystatin C in patients with head and neck carcinoma. Clinica Chimica Acta, 344, 2004, s. 155-161.
29. Strojan, P., Budihna, M., Smid, L., Svetic, B., Vrhovec, I., Skrk J.: Cathepsin B and L and stefin A and B levels as serum tumor markers in squamous cell carcinoma of the head and neck, Neoplasma, 48, 2001, s. 66-71.
30. Tartour, E., Deneux, L. Mosseri, V., Jaulerry, C., Brunin, F. et al.: Soluble interleukin 2 receptor serum level as a predictor of locoregional control and survival for patients with head and neck carcinoma: results of a multivariate prospective study. Cancer, 79, 1997, s. 1401-1408.
31. Vermorken, J.: Medical treatment in head and neck cancer. Annals of Oncology, 16, 2000, s. 258-264.
32. Warawdekar, U., Zingde, S., Iyer, K., Jagannath, P., Mehta, A., Mehta, N.: Elevated levels and fragmented nature of cellular fibronectin in the plasma of gastrointestinal and head and neck cancer patiens. Clinica Chimica Acta, 372, 2006, s. 83-93.
33. Yen, T. C., Lin, W. Y., Kao, C. H., Cheng K. Y., Wang, S. J.: A study of a new tumour marker, cyfra 21-1 in squamous cell carcinoma of the head and neck, and comparison with squamous cell carcinoma antigen. Clin. Otolaryngol, 23, 1998, 1, s. 82-86.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)Article was published in
Otorhinolaryngology and Phoniatrics

2008 Issue 2
Most read in this issue
- Chirurgická liečba tumorov priušnej žľazy v súbore Kliniky ORL a chirurgie hlavy a krku ÚVN v Ružomberku v rokoch 1995 – 2006
- Fibrózní dysplázie a cholesteatom
- Hirudoterapia v rekonštrukčnej chirurgii hlavy a krku - naše prvé skúsenosti
- Spontánní tympanoplastiky - padesát roků od jejich poznání